Если нарушения репарационных систем и связанная с ними нуклеотидная нестабильность причастны к развитию относительно небольшого числа определенных форм опухолей, то хромосомная нестабильность, вытекающая из нарушений нормальной регуляции клеточного цикла, характерна для подавляющего большинства солидных опухолей. В клеточном цикле постулировано существование так называемых сверочных точек (checkpoints), прохождение которых возможно лишь в случае нормального завершения предыдущих этапов и отсутствия поломок.Нарушения функции р53, характерные для большинства различных новообразований человека, значительно ослабляют контрольные функции сверочных точек клеточного цикла и одновременно ингибируют индукцию апоптоза, что наряду с некоторыми другими последствиями дисфункции р53, резко увеличивает вероятность появления пролиферирующих клеток со спонтанно возникшими или индуцированными генетическими аномалиями. Важно подчеркнуть, что восстановление нормальной функции р53 в утративших ее клетках, наоборот, приводит к уменьшению темпа возникновения генетических нарушений.
Итак, часто встречающиеся в новообразованиях человека инактивация опухолевых супрессоров и(или) активация протоонкогенов приводят к дисфункции сверочных точек клеточного цикла и нестабильности генома. Кроме того, в опухолевых клетках закономерно выявляются изменения и некоторых других генов, ответственных за поддержание целостности генома. Следует отметить, что врожденные инактивирующие мутации генов репарационных систем неизменно приводят к развитию определенных новообразований. Это свидетельствует о важнейшей роли генетической нестабильности в генезе опухолей и(или) их дальнейшей прогрессии. Хотя повышенная нестабильность генома не является строго необходимой для онкогенеза,без нее практически невозможно возникновение в одной клетке достаточного числа мутаций, определяющих злокачественный характер роста солидных опухолей. Создавая гетерогенность клеточных популяций, генетическая нестабильность постоянно предоставляет материал для отбора все более и более автономных и агрессивных клеток. Ярким отличительным свойством неопластических клеток является асоциальный тип их поведения, связанный в первую очередь с нарушениями нормальных морфогенетических реакций — потерей контактного торможения, приобретением способности к пролиферации независимо от прикрепления к субстрату, изменениями адгезионных взаимодействий, формы и подвижности клеток и т.д. Именно эти нарушения вместе с некоторыми другими свойствами, в частности способностью секретировать протеолитические энзимы и ангиогенные факторы, предопределяют инвазивный характер роста (проникновение в окружающие здоровые ткани), а впоследствии — и метастазирование (образование вторичных очагов опухолевого роста). Первостепенную роль в возникновении указанных выше нарушений морфогенетических реакций играют изменения функции протоонкогенов и (или) опухолевых супрессоров.
Неоангиогенез — формирование сети капилляров из эндотелиальных клеток, выстилающих мелкие венулы, — необходимое условие для дальнейшего роста опухолевого узелка, достигшего в диаметре 2—4 мм. Приобретение неопластическими клетками способности стимулировать пролиферацию и миграцию эндотелиальных клеток связано, очевидно, с двумя основными процессами: прекращением секреции ими факторов, ингибирующих ангиогенез (тромбоспондины и др.), и увеличением продукции цитокинов, являющихся факторами роста для эндотелиоцитов, сопровождающимся повышением секреции и(или) активности протеаз, обеспечивающих протеолиз внеклеточного матрикса и инвазию эндотелиоцитов в ткани новообразования. Ключевую роль в возникновении ангиогенного фенотипа неопластических клеток играет инактивация функции опухолевого супрессора р53, контролирующего экспрессию некоторых ингибиторов и стимуляторов ангиогенеза.
Метастазирование — образование вторичных очагов опухолевого роста — наиболее опасное проявление прогрессии новообразований, являющееся основной причиной смерти онкологических больных. Чтобы дать метастаз, клетка должна приобрести ряд свойств: умение проникать в глубину окружающих нормальных тканей (в том числе в кровеносные или лимфатические сосуды), способность выживать после попадания в сосуды,а затем пенетрировать их и размножаться в несвойственном для данного типа клеток микроокружении, давая новый очаг опухолевого роста. Появление каждого из этих признаков увеличивает вероятность развития метастатического потенциала. Наиболее важными представляются гены и белки (например, р53, Ras и Src), изменения активности которых приводят к возникновению сразу нескольких компонентов метастатического фенотипа и, кроме того, к генетической нестабильности, облегчающей появление дополнительных признаков, необходимых для метастазирования. Чтобы образовать из одной клетки-родоначальницы сначала опухоль, а затем и метастазы, требуется очень большое число клеточных делений. Между тем хорошо известно, что существует механизм, ограничивающий число делений большинства нормальных клеток (заведомое исключение составляют стволовые клетки). Так, в культурах in vitro фибробласты и эпителиальные клетки человека после 50—60 делений (так называемоечисло Хейфлика) необратимо останавливаются в G1- или 02-фазах клеточного цикла (этот феномен получил название «репликативное старение»). В основе работы такого счетно-ограничительного механизма лежит прогрессивное укорочение длины теломер в результате неполной репликации концевых участков хромосом в каждом из митотических циклов. По существующим представлениям остановка клеточного цикла обусловлена образованием «липких» концов хромосом, что вызывает их соединение и запуск реакций, аналогичных наблюдаемым при действии ДНК-повреждающих агентов. Однако в клетках с активной теломеразой — ферментом, осуществляющим элонгацию de novo теломерных повторов ДНК, или при активизации других, так называемых «альтернативных механизмов удлинения теломер», основанных, в частности, на нереципрокной рекомбинации их участков, может происходить отмена ограничения на число делений — иммортализация (приобретение бессмертия). Об этом свидетельствуют две группы фактов: 1) в отличие от нормальных тканей человека в клетках большинства опухолей, как и в стволовых клетках, теломераза активна; 2) трансдукция векторов, экспрессирующих каталитическую субъединицу теломеразы (TERT), увеличивает продолжительность жизни нормальных человеческих клеток некоторых линий по крайней мере еще на 20 делений. Нарушения клеточной дифференцировки — характерная черта опухолевых клеток, широко используемая для диагностики новообразований. Особенно ярко она проявляется в гемобластозах, как правило, представляющих собой клоны клеток, как бы замороженных на той или иной стадии созревания. Общепринятым является представление, согласно которому меньшая зрелость лейкозных клеток является не следствием дедифференцировки зрелых клеток, претерпевших неопластическую трансформацию, а отражает их происхождение из незрелых клеток, в которых блокированы процессы дальнейшей дифференцировки. Сохранение способности к дифференцировке наблюдается и во многих солидных опухолях. Причем в отличие от лейкозов созревание клеток не препятствует приобретению злокачественного фенотипа. Примерами этого могут служить плоскоклеточные ороговевающие раки кожи и высокодифференцированные аденокарциномы толстой кишки. Следует подчеркнуть, что происхождение из незрелых клеток не противоречит представлению о том, что опухолевые клетки в ходе прогрессии могут претерпевать определенную дедифференцировку, утрачивая в первую очередь те дифференцировочные маркеры, отсутствие которых придает клеткам селективные преимущества (рецепторы стероидных гормонов в раках молочной железы и др.). С другой стороны, как справедливо отмечают Г.И. Абелев и С. Селл, полной потери признаков тканевой принадлежности в опухолях практически никогда не наблюдается, что может объясняться тканеспецифичным характером экспрессии определенных онкогенов или других генов, функционирование которых необходимо для поддержания неопластической трансформации.
Итак, канцерогенез — многоступенчатый процесс накопления мутаций и других генетических изменений, приводящих к нарушениям регуляции клеточного цикла, апоптоза, дифференцировки, морфогенетических реакций клетки, а также, вероятно, к неэффективному функционированию факторов специфического и неспецифического противоопухолевого иммунитета. Ключевую роль в возникновении указанных свойств неопластической клетки играют нарушения функции опухолевых супрессоров и протоонкогенов. Исследования последних лет позволили идентифицировать сигнальные пути, контролируемые большинством этих генов. Выяснилось, что многие из них регулируют активность одних и тех же путей на разных этапах передачи сигналов. Оказалось также, что некоторые из таких сигнальных путей одновременно вовлечены в регуляцию нескольких важнейших физиологических процессов. С другой стороны, продукты некоторых из опухолевых супрессоров и протоонкогенов являются местами пересечения различных сигнальных путей. Отсюда становится понятной частая встречаемость изменений генов р53 и RAS в самых разных новообразованиях — их мутации позволяют за один шаг преодолеть несколько важных этапов опухолевой прогрессии и придать неопластической клетке сразу несколько необходимых свойств.
В то же время для ряда новообразований, и в первую очередь для лейкозов, характерны генетические изменения, встречающиеся только при данном заболевании. К ним относятся прежде всего хромосомные транслокации, перемещающие протоонкогены и(или) опухолевые супрессоры в другое место генома.
Генетические изменения, возникшие под влиянием канцерогенов, включают активацию онкогенов посредством мутаций специфических участков и потери участков хромосом — генов опухолевой супрессии. Потомство такой клетки после ее деления наследует эти генетические изменения, но окружающие клетки остаются нормальными. Так как генетические изменения затрагивают только раковые клетки, они не передаются детям онкологических больных. Подавляющее большинство опухолей человека не являются наследственными, за исключением редких генетических синдромов. Наследственность в большей степени влияет на индивидуальную предрасположенность в развитии рака, определяя особенности метаболизма канцерогенных веществ и способность репарировать ДНК. Генетические изменения, наследующиеся и с высокой вероятностью приводящие к развитию рака, обычно выражаются в мутациях одного аллеля гена-супрессора. Идентифицирован ряд генов-супрессоров, врожденные мутации которых приводят к развитию наследственных и семейных форм злокачественных новообразований. К таким генам относится ген ретинобластомы, рака молочной железы, аденоматозного полипоза толстой кишки, неполипозного врожденного рака толстой кишки, нейрофиброматоза. Относительный риск развития опухоли у людей с врожденными мутациями в генах-супрессорах очень велик, а в ряде случаев вероятность развития рака достигает 100%. Однако частота самого этого явления, т. е. наличие врожденных мутаций, крайне редка и встречается не более 1—5 случаев на 100 ООО новорожденных. Соответственно низка и доля злокачественных опухолей, этиологически связанных с подобными генетическими событиями. Стадии канцерогенеза могут быть описаны как инициация, когда ростовая потенция экспонированных клеток изменяется необратимо, и прогрессия, обозначающая множество циклов клеточной репликации, обеспечивающей постепенное прохождение инициированной клетки в направлении автономного злокачественного роста. По определению JI. Фулдса, прогрессия опухоли — это развитие опухоли путем устойчивых необратимых качественных изменений одного или нескольких ее признаков (инвазивность, способность к метастазированию и т.д.). В процессе прогрессии эти признаки развиваются в сторону нарастания злокачественности независимо друг от друга.
Последний этап распространения малигнизированных клеток в своем итоге приводит к множественному поражению опухолями, так называемыми метастазами. Злокачественные новообразования характеризуются чрезвычайной вариабельностью клинического течения: от агрессивного до относительно доброкачественного, индолентного. Каждому клиницисту известны больные с медленно растущими опухолями, с поздним и редким метастазированием. Не являются исключением и злокачественные опухоли изначально высокоагрессивные, с бурным ростом, ранним и множественным метастазированием.
Период времени от гипотетической первой раковой клетки до смерти больного после достижения опухолью критической массы получил название естественной истории роста. Ее продолжительность зависит от скорости роста опухоли и метастазов, а также времени начала процесса метастазирования. Описание кинетики злокачественных новообразований приводится на примере рака молочной железы (РМЖ) как наиболее полно изученной. Для описания развития первичного РМЖ было предложено несколько моделей. Наиболее простая модель роста разработана J. Schwartz (1961). Согласно этой модели (рис. 14) естественная история роста начинается от гипотетической первой клетки и завершается гибелью организма после 40 удвоений объема. При этом клеточная популяция достигает 1013 и опухолевая масса — 1 кг. Предполагается, что опухоль растет экспоненциально (с постоянной скоростью) и более 3/4 истории (от первой клетки до Ю9 клеток, или 1 см3 объема) на доклиническом этапе. Не более 1/4 приходится на клинический этап. Несмотря на внешнюю простоту, эта модель позволяет сделать очень важные выводы как с теоретической, так и с практической точки зрения: 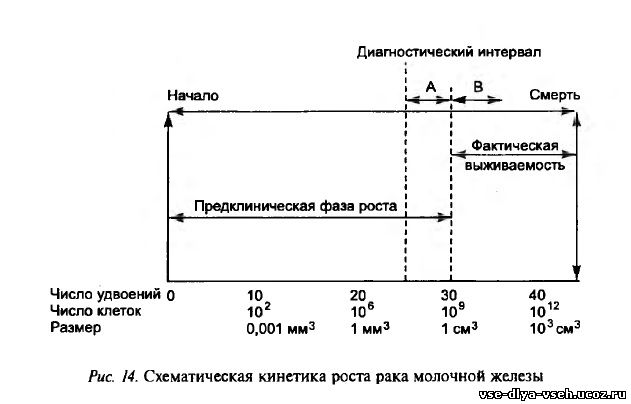
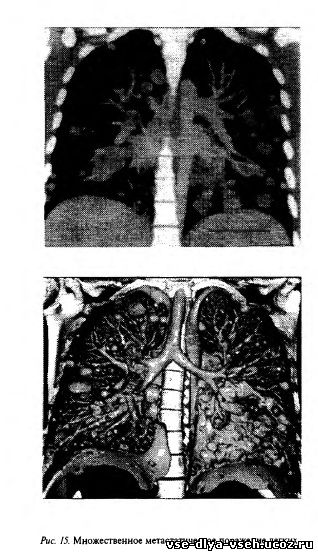
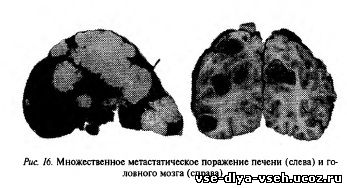
— предклиническая фаза представляет собой подводную часть «айсберга», доминируя в естественной истории развития РМЖ над клинической фазой, и по существу, каким бы ранним ни был РМЖ с клинической точки зрения, с биологической точки зрения он будет поздним, так как всегда существует уже в течение длительного времени; — продолжительность естественной истории развития РМЖ в каждом конкретном случае определяется скоростью его роста. Опухоли с высокой скоростью роста имеют естественную историю короче, чем с медленной. Опухоль может быть определена с помощью пальпации при размере, превышающем 1 см, когда число клеток в ней составляет 10 в 9 степени. Для достижения этого размера требуется более 30 удвоений объема. Согласно расчетам С. Henderson и соавт., допустив экспоненциальный характер роста РМЖ и приняв среднее время удвоения, равное 100 дням, легко подсчитать, что продолжительность естественной истории роста до клинической манифестации равна 10 годам. Причем она может колебаться от 1,75 года при скорости роста менее 35 дней до 18,4 года при времени удвоения более 110 дней. При этом средняя продолжительность предклинического этапа для первичного РМЖ составляет 8,4 года.Очевидно, что продолжительность роста РМЖ как от 1 клетки, так и от Ю3 клеток (в случае поликлонального происхождения) до клинической манифестации не может даже теоретически продолжаться несколько месяцев (как это считалось ранее), так как в этом случае время удвоения опухоли должно быть менее 1 дня (!). Между тем максимальная скорость роста, зарегистрированная для первичного РМЖ у человека, составляет 3—8 дней и отмечена только у нескольких больных. Из этих расчетов следует очень важный вывод о том, что РМЖ является хроническим заболеванием, характеризующимся длительной естественной историей развития. Опухоли с временем удвоения более 400 дней растут настолько медленно, что часто не успевают достичь клинически определимого размера на протяжении всей жизни. Вторым по значимости этапом после инициации опухоли является начало метастазирования — способность злокачественных опухолей к росту вторичных опухолей, находящихся в отдалении от первичного очага злокачественного роста. Метастазы — последний шаг в многостадийном процессе опухолевой прогрессии и во многих случаях, главной причиной смерти онкологических больных (рис. 15, 16). Предполагается, что формирование метастазов является длительным процессом, начинающимся на ранних этапах естественной истории развития и нарастающим со временем.Принципиальная возможность метастазирования появляется уже с началом ангиогенеза в опухоли. Ранее считалось, что ангиогенез начинается после того, как количество опухолевых клеток превысит 103 (только 1000 клеток), а диаметр опухоли будет 0,5 мм. Однако недавно было показано, что процесс формирования в опухоли сосудов может начинаться еще раньше — при числе клеток, равном 100—200. С этого момента раковые клетки уже могут попадать в кровяное русло.
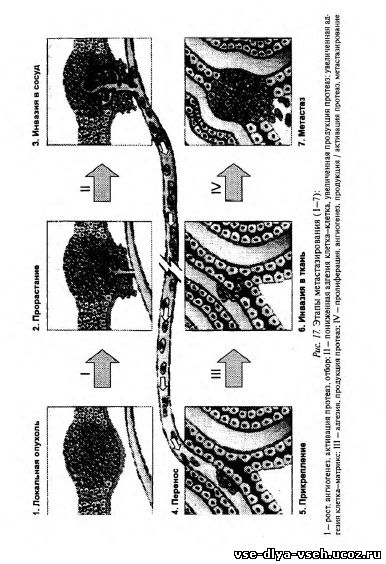
Очевидно, что процесс метастазирования от начала до конца является динамичным и непрерывным (рис. 17). Опухолевые клетки, которые в конце концов дают начало метастазу, перед этим должны пройти сложнейший путь и выжить в потенциально летальных взаимодействиях с гомеостатическими системамиорганизма. Успех выживания зависит от особенностей организма и определенных характеристик опухолевых клеток. Причем выживают только единичные клетки. Между тем организм «наводнен» метастатическими опухолевыми клетками. Поэтому не удавалось выявить корреляции между определением опухолевых клеток в периферической крови и прогнозом заболевания.
Кратко основные этапы метастазирования могут быть разделены следующим образом: 1) появление группы опухолевых клеток. Их первоначальный рост обеспечивается питательными веществами, поступающими в клетки путем диффузии из окружающей микросреды; 2) опухолевый ангиогенез — обязательный этап метастазирования. Он начинается не позже достижения опухолью 0,5 мм в диаметре. При этом центральные клетки уже не могут получать питательные вещества только путем диффузии. В инициации и процессе ангиогенеза ключевую роль играет синтез опухолевыми клетками ангиогенных факторов; 3) инвазия окружающей опухоль стромы может происходить с помощью нескольких механизмов: — быстро пролиферирующая опухоль способна создавать повышенное давление и выталкивать клетки за ее пределы; — опухоли, растущие в больших полостях, могут рассеивать свои клетки через слизистую или серозную поверхности; — гематогенного и лимфогенного распространения; 4) интравазация, т.е. проникновение в сосудистое русло, после преодоления опухолью стромы циркуляторной системы. При этом большинство (99,9%) раковых клеток погибает. В ряде радиоизотопных исследований было показано, что выживает не более 0,1% клеток, циркулировавших с током крови или лимфы. Очевидно, что циркулирующие опухолевые клетки более чувствительны как к иммунным, так и к неиммунным защитным механизмам, включая турбуленцию кровотока и травму клеток при эмболизации и экстравазации и лизис их лимфоцитами, моноцитами и естественными киллерами;5) если опухолевым клеткам удается выжить после циркуляции с током лимфы или крови, то на следующем этапе они должны задержаться в капиллярном русле какого-либо отдаленного органа путем либо прилипания к эндотелиальным клеткам либо к базальной мембране капилляра; 6) экстравазация предположительно аналогичным интрава- зации путем; 7) рост опухолевого узла в паренхиме завершает этапы метастазирования. Для начала такого роста опухолевая клетка должна обладать колониеобразующей способностью и, как в случае первичной опухоли, синтезировать ангиогенные факторы для развития собственной сосудистой системы. Эти метастазы могут давать начало новым метастазам, так называемым «метастазам из метастазов». Важно отметить, что для того, чтобы метастаз достиг клинически определимых размеров, каждый этап метастатического процесса должен быть полностью завершен. Невозможность успешного завершения одного или нескольких из перечисленных этапов приводит к элиминации клетки и неэффективному метастазированию. В связи с тем, что при этом выживают только отдельные клетки, развитие метастаза означает селекцию из первичной опухоли субпопуляции метастатических клеток. Впервые экспериментальные доказательства гетерогенности опухоли с точки зрения метастатического потенциала были представлены I. Fidler и М. Kripke в 1977 г. Эти данные, а также факты, показавшие, что результат прохождения клетками этапов метастазирования зависит от особенностей организма больного (так называемой микросреды, в которой оказывается опухолевая клетка), подтверждают концепцию, что процесс метастазирования не является случайным, а в его основе лежит селекция клонов.