Канцерогенез — сложный многостадийный процесс, протекающий на молекулярном, генетическом, клеточном, тканевом, органном и организменном уровнях в результате воздействия и взаимодействия различных по своей природе экзо- и эндогенных канцерогенных, коканцерогенных и антиканцерогенных факторов, обладающий на определенных стадиях обратимостью и приводящий при неблагоприятных для организма условиях к развитию злокачественной опухоли, основными чертами которой являются неконтролируемый рост, врастание в окружающие ткани и органы, анаплазия и метастазирование.
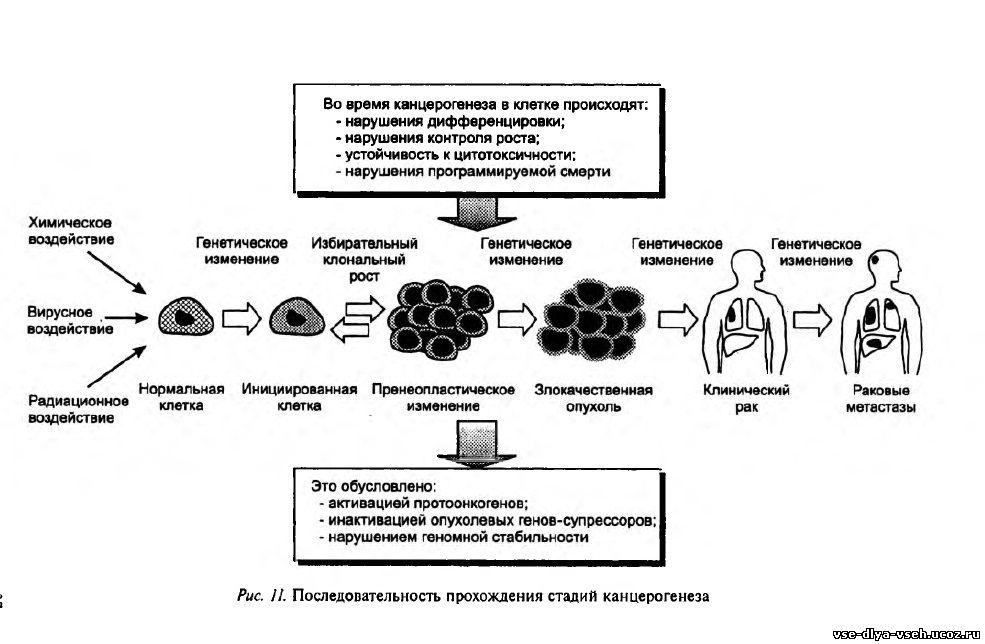
Последовательность прохождения стадий канцерогенеза в схематическом виде представлена на рис 11. Они обозначаются как стадия инициации, промоции и прогрессии. Переход из одной стадии канцерогенеза в другую (последующую или предыдущую) происходит в результате воздействия внешних и внутренних факторов, которые могут как способствовать, так и противодействовать этому процессу. Главным достижением в исследовании рака в течение последних десятилетий XX в. явилось разъяснение многостадийности канцерогенеза на молекулярно-генетическом уровне. Для понимания этих процессов следует в первую очередь остановиться на кратком описании самого понятия канцероген.
Канцерогеном (физическим, химическим или биологическим) называется агент, способный вызвать развитие злокачественного новообразования независимо от механизма его действия или степени специфичности эффекта. Он в силу своих физических или химических свойств может вызвать необратимые изменения или повреждения в тех частях генетического аппарата, которые осуществляют гомеостатический контроль над соматическими клетками. Химические канцерогены. Понятие химических канцерогенов возникло на основании наблюдений за развитием так называемого профессионального рака, т. е. опухолей, возникавших особенно часто у лиц, имевших длительный контакт с канцерогенными агентами в процессе профессиональной деятельности. Первое наблюдение такого рода было описано уже свыше 200 лет тому назад в 1775 г. Персивалем Поттом.Это рак мошонки у трубочистов, развившийся вледствие хронического загрязнения кожи продуктами перегонки каменного угля: смо-лой, сажей. С этого времени стало известно, что каменноугольные смолы являются канцерогенными агентами. В конце XIX в. появились первые сообщения о раке мочевого пузыря у работников анилинокрасочных производств, а еще раньше - о чахотке рудакопов Шнееберга в Саксонии и Яхимова в Чехии, которая оказалась раком легкого, вызванного радиоактивными веществами (именно в яхимовской руде супруги Кюри открыли радий). В настоящее время известно более тысячи химических соединений, способных вызывать опухоли. Наиболее распространенными и активными канцерогенами являются:
1) полициклические ароматические углеводороды (ПАУ);
2) ароматические амины и амиды, химические красители, широко применяемые в промышленности;
3) нитрозосоединения;
4) афлотоксины и другие продукты жизнедеятельности растений и грибов;
5) гетероциклические ароматические углеводороды;
6) прочие (четыреххлористый углерод, этианин, уретан, тиоацетомид, эпоксиды, металлы, пластмассы и др.).
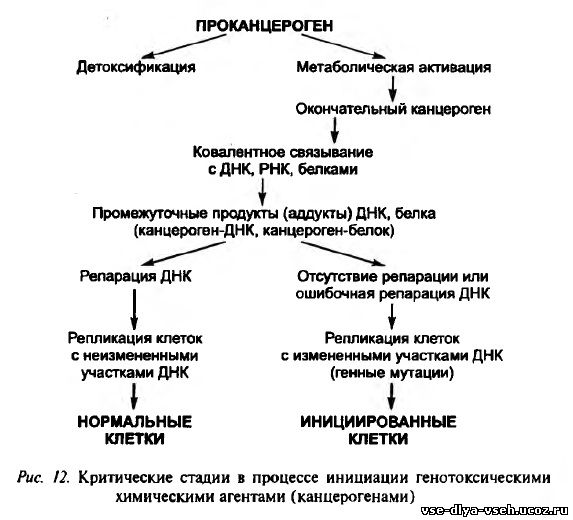
При рассмотрении химической структуры канцерогенов видно, насколько различна их природа, а для многих этих веществ характерна химическая инертность. Химические вещества или соединения, которые вызывают развитие злокачественной опухоли, без необходимости каких- либо других дополнительных воздействий, называют полными (истинными или конечными) канцерогенами. Они обладают свойствами инициаторов и промоторов. Однако большинство химических канцерогенов приобретает способность вызыватьопухоли после метаболической активации в организме животных и человека. Изучение механизмов действия химических канцерогенов показало, что они почти все являются только проканцерогенами. Чтобы стать истинными канцерогенами, они должны подвергнуться в организме так называемой активации, в результате которой могут возникнуть метаболиты с бластомогенной активностью. Критическим событием в процессе химического канцерогенеза является ковалентное связывание метаболитов канцерогенных веществ с ДНК и белками и образование адцуктов (канцероген- ДНК и канцероген-белок), которые, в свою очередь, приводят к возникновению в клеточных генах точковых (точечных) мутаций и других повреждений. В результате происходит активация онкогенов и инактивация генов-супрессоров.
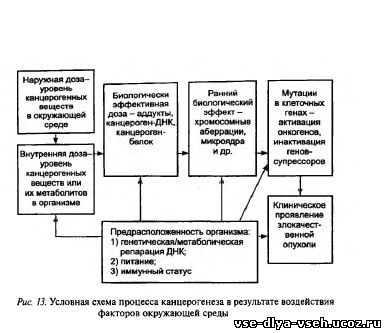
Схематически критические стадии в процессе инициации генотоксическими химическими агентами (канцерогенами) представлены на рис. 12. Воздействие канцерогенного вещества на человека может быть охарактеризовано с помощью наружной дозы — концентрации этого вещества в окружающей среде; внутренней дозы —его концентрации во внутренней среде организма (кровь, моча, ткани и т.д.); биологически эффективной дозы — количестве экзогенного канцерогена или его метаболита, которое связывается с ДНК или белками (рис. 13). Уровень аддуктов ДНК в ткани-мишени, крови и моче зависит от многих переменных: наружной дозы канцерогена, абсорбции и распределения канцерогена в организме, метаболической активации канцерогенного вещества, химической стабильности метаболитов и аддуктов ДНК, эффективности репарации и репликации ДНК. Таким образом, этот маркер (в отличие от маркеров наружной и внутренней дозы) отражает и индивидуальные особенности организма. Адцукты ДНК образуются с конкретными канцерогенными веществами. По ним можно идентифицировать вещества, которые привели к повреждению ДНК. Они позволяют прогнозировать последующий риск развития рака точнее, чем наружная и внутренняя дозы. Но этот маркер является кратковременным, так как адцукты довольно быстро удаляются из организма. Маркеры раннего биологического эффекта более постоянны, отражают поздние этапы канцерогенеза, которые характеризуются повреждением генетического аппарата клетки и в итоге приводят к активации онкогенов и инактивации генов- супрессоров. К ним относятся цитогенетические маркеры ранних стадий канцерогенеза, а именно — появление в клетках микроядер, хромосомных аберраций, сестринского хроматинного обмена и т.д. Недостатком маркеров раннего биологического ответа является их неспецифичность. Маркерами более поздних стадий канцерогенеза являются онкогены и гены-супрессоры, которые можно обнаружить как в тканях-мишенях, так и в других биологических средах. Онкогены — это клеточные или вирусные (вносимые вирусом в клетку) гены, экспрессия которых может привести к развитию новообразования. Протоонкогены — нормальные клеточные гены, усиление или модификация функции которых превращает их в онкогены. Опухолевые супрессоры (антионкогены, рецессивные опухолевые гены) — клеточные гены, инактивация которых резко увеличивает вероятность возникновения новообразований, а восстановление функции, наоборот, может подавить рост опухолевых клеток. Однако долгое время знания о каждом из онкогенов или опухолевых супрессоров представлялись дискретными, в значительной мере не связанными между собой. И лишь в самые последние годы стала вырисовываться общая картина, показывающая, что подавляющее большинство известных протоонкогенов и опухолевых супрессоров являются компонентами нескольких общих сигнальных путей, контролирующих клеточный цикл, апоптоз, целостность генома, морфогенетические реакции и дифференцировку клеток. Очевидно, изменения именно в этих сигнальных путях в конце концов и приводят к развитию злокачественных новообразований. Ниже приведены сведения об основных мишенях действия онкогенов и опухолевых супрессоров.Многие участники сигнальных путей, опосредующих в ответ на действие ростовых факторов стимуляцию клеточного деления, являются протоонкогенами. Изменения их структуры (мутации), приводящие к ускользанию от воздействия негативных регуляторных факторов и (или) перманентному повышению экспрессии, превращают такие протоонкогены в онкогены. Складывается впечатление, что при детальном анализе в каждом новообразовании выявляются изменения хотя бы одного из компонентов сигнальных путей (протоонкогенов), вызывающие перманентную стимуляцию активности циклинзависимых киназ и инициацию клеточного деления вне зависимости от действия ростовых факторов. Другой важнейшей точкой приложения активностей онкогенов и опухолевых супрессоров является регуляция апоптоза (программированной гибели клеток). Апоптоз, как известно, вызывается различными сигналами: связыванием с рецепторами специфических киллерных лигандов, нехваткой факторов роста (выживания), повреждениями ДНК и разрушениями цитоскелета, гипоксией и другими неблагоприятными условиями. В регуляции апоптоза выделяют два основных этапа: фазу индукции (принятия решения) и фазу экзекуции (исполнения приговора). Последняя осуществляется путем активации кас-паз — семейства цистеиновых протеиназ. Расщепление каспазами (так называемыми «эффекторными» или «казнящими»каспазами) ряда ключевых субстратов приводит к фрагментации Д Н К и деструкции клетки.Однако для развития злокачественных форм солидных опухолей требуются и другие изменения, в первую очередь обусловливающие нарушения взаимодействия клеток со своими соседями и внеклеточным матриксом, в частности, потерю ими зависимости от субстрата и контактного торможения размножения; повышенную локомоторную активность, ответственную за инвазию в окружающие ткани, способность неопластических клеток стимулировать прорастание сосудов (неоангиогенез) в ткани опухоли для обеспечения ее питания. В связи с этим неудивительно, что в клетках солидных опухолей число выявляемых мутаций и других генетических изменений, как правило, значительно выше, чем в клетках лейкозов. Число генетических перестроек нередко достигает в них нескольких десятков. Исходя из обычного темпа мутирования, характерного для нормальных клеток, нельзя объяснить появления в одной клетке такого количества генетических нарушений. Поэтому, прежде чем перейти к анализу роли протоонкогенов и опухолевых супрессоров в регуляции морфогенетических реакций клетки и неоангиогенеза, рассмотрим механизмы возникновения генетической нестабильности — еще одного важнейшего признака неопластической клетки. Наблюдающееся в неопластических клетках подавление индукции апоптоза повышает жизнеспособность клеток, подвергшихся ДНК-повреждающим воздействиям, и увеличивает вероятность сохранения возникших генетических нарушений. Однако в клетке существуют и другие, более специализированные системы контроля целостности генома, нарушения работы которых также характерны для опухолевых клеток. Системы контроля целостности генома условно можно разделить на две группы: 1) репарационные системы, выявляющие и исправляющие ошибки, которые приводят к изменениям последовательности нуклеотидов в ДНК; 2) системы контроля клеточного цикла, предотвращающие дальнейшее размножение клеток, в которых уже произошли или могут произойти нарушения структуры или числа хромосом. Изменения систем репарации характерны для относительно небольшой части новообразований.