Болевой синдром
Как минимум треть больных с впервые диагностированным злокачественным новообразованием и две трети больных с распространенным опухолевым процессом страдают от боли. Болевой синдром может быть эффективно купирован у 90% больных раком. Однако, по данным опроса, проведенного североамериканской Eastern Cooperative Oncology Group, 86% из 897 опрошенных онкологов считают, что медикаментозное лечение болевого синдрома у большинства больных было недостаточным.
Хронический болевой синдром снижает качество жизни, приводит больного к тяжелейшей депрессии и настойчивым мыслям о суициде. Помимо воздействия на больного, боль негативно сказывается на его окружении. Кроме семьи, определенные испытания выпадают на долю лечащего врача, который должен правильно оценить болевой синдром у конкретного больного. Поскольку боль является субъективным ощущением больного, необходимо помнить, что информация, получаемая в ходе общения с больным, не всегда верна. Больные часто склонны занижать интенсивность болей, когда речь идет о применении наркотических анальгетиков — из опасения развития зависимости, страха, связанного с необоснованным представлением о том, что назначение этих препаратов равносильно смертному приговору. Поэтому важной составной частью лечения болевого синдрома у онкологических больных является доверительная беседа с больным и желательно с членами его семьи. Готовность больного сотрудничать с врачом —необходимое условие успешного лечения болевого синдрома.
В каждом случае лечения сильного болевого синдрома на первом этапе следует определить, не связан ли болевой синдром с каким-либо неотложным состоянием (патологическим переломом, метастатическим поражением головного мозга, мозговых оболочек, перфорацией полого органа либо инфекционным процессом). Если такое состояние выявлено, проводится соответствующее лечение.
В тех случаях, когда болевой синдром не связан с неотложным состоянием, решение о дальнейшей тактике принимается в зависимости от выраженности болевого синдрома и анамнестических данных — в первую очередь в отношении предшествующего приема наркотических анальгетиков.
Оценка интенсивности болевого синдрома. Начальная оценка болевого синдрома включает тщательный сбор анамнеза с акцентом на характеристики болевого синдрома, физикальное исследование, оценку состояния психики больного, диагностических перспектив, прогноза. При назначении лечения анальгетиками врач определяет сроки следующего осмотра с целью оценки изменений в интенсивности и характере боли.
Оценка интенсивности болевого синдрома производится, как правило, при помощи специальной шкалы (рис. 19), которая представляет собой линию длиной 10 см, градуированную слева направо от отметки «Нет боли» до отметки «Невыносимая боль». Наиболее часто применяется вариант шкалы, построенный в виде линейки, где на стороне, обращаемой к больному, на шкале отсутствуют деления, а оставлены только вышеупомянутые обозначения. Больному предлагается указать точку на шкале, соответствующую его болевым ощущениям. На стороне линейки, обращенной к врачу, имеется градуированная от 0 до 10 шкала, позволяющая количественно фиксировать интенсивность болевого синдрома для последующего контроля эффективности лечения.
Выбор анальгетиков и дозового режима. Лечение болевого синдрома обычно начинают на основании оценки его интенсивности, сделанной самим больным. Основой является трехступенчатое лечение болевого синдрома, предложенное Всемирной организацией здравоохранения, — «лестница ВОЗ» (рис. 20).
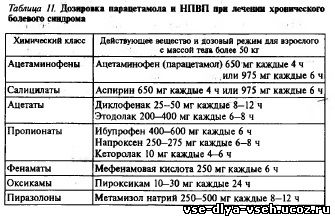
Лечение больных, оценивающих болевой синдром как слабовыраженный (1—3 балла по ВАШ), обычно начинают с назначения парацетамола (спектр токсических проявлений которого наиболее приемлем),или других нестероидных противовоспалительных препаратов (НПВП). Выбор дозы и режима введения НПВП осуществляется эмпирически. Обязательное условие оценки эффективности лечения — прием препарата в предписанной дозе с предписанным интервалом в течение достаточного времени. Следует достигнуть необходимого анальгезирующего эффекта при условии, что интенсивность боли не нарастает и в процессе подбора анальгетика больной не испытывает страданий. Рекомендуемые дозы и интервалы введения препаратов этой группы приведены в табл. 11

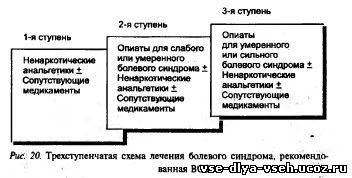
В тех случаях, когда нестероидные противовоспалительные препараты исходно не позволяют добиться удовлетворительного эффекта, либо возможности их применения исчерпаны, показано назначение так называемых «слабых» опиатов- (2-я ступень «лестницы ВОЗ») — обычно это кодеин либо трамадол (табл. 12). Эти препараты рекомендуется назначать в комбинации с НПВП. За счет того, что НПВП имеют преимущественно периферический механизм действия, а опиаты — центральный, их комбинированное применение позволяет снизить дозу наркотических препаратов. Наиболее часто используется сочетание кодеин — парацетамол, при этом рекомендуется использовать максимальную дозу парацетамола — 4000 — 6000 мг/сут. Оправданным является и назначение сильных опиатов, когда ожидается неуклонное усиление болевого синдрома. При этом одновременное назначение препаратов 2-й и 3-й ступени недопустимо.
Больные с сильным болевым синдромом или больные с болями меньшей интенсивности, но резистентными к предыдущим ступеням лечения, получают ;так называемые «сильные» наркотические анальгетики, в первую очередь морфин. Лечение хронического болевого синдрома должно осуществляться строго по составленной схеме («по часам») е соблюдением дозового режима и интервалов введения, Лишь обострение болей, носящее преходящий характер, требует дополнительного лечения, заключающегося чаще всего в дополнительном применении быстро действующих форм опиатов с короткой длительностью эффекта («доза болевого приступа»), обычно определяемая как 10—20% суточной дозы морфина. Необходимость такого дополнительного приема наркотического анальгетика определяется самим больным («контролируемая больным анальгезия»). Недопустимо сочетание анальгетиков 2-й и 3-й ступени (например, трамадола и морфина).
Недопустимы ситуации, при которых наркотические анальгетики назначаются спорадически. Подбор дозировки «сильных» наркотических анальгетиков рекомендуется начинать с применения опиатов с коротким периодом полувыведения во избежание кумуляции препарата.
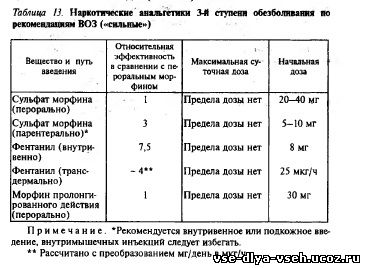
Процесс подбора режима введения препарата называется титрованием— при недостаточном анальгезирующем эффекте производится повышение разовой дозы препарата или уменьшение интервалов между введениями, а при полном исчезновении болевого синдрома (на фоне химио- либо лучевой терапии) возможно ступенчатое снижение дозы анальгетика вплоть до полного·прекращения приема. После определения дозы возможен перевод на лекарственные формы пролонгированного действия при помощи таблицы изоэквивалентных доз (табл. 13)
Для наркотических анальгетиков не существует верхнего порога дозы. При развитии привыкания или при увеличении интенсивности болевого синдрома доза может достигать 1000 мг/сут и более. Лимитирующим в такой ситуации является развитие побочных эффектов. Способ приема. В настоящее время применяется целый ряд способов введения анальгетиков, включая пероральный, чрескожный (пластырь), сублингвальный, внутривенный, подкожный, интраспинальный, интрацеребральный, ректальный. Предпочтение отдается менее инвазивным способам введения перед более инвазивными. Внутримышечное введение анальгетиков не рекомендуется. Причины — болезненность инъекций, неравномерность всасывания, возможность инфекционных осложнений, а также опасность применения у больных с цитопеническими синдромами.
Побочные эффекты. При назначении парацетамола в первую очередь необходимо помнить о гепатотоксичности больших доз препарата и,с осторожностью применять его у больных с поражением печени. Для остальных НПВП более характерна гастроинтестинальная токсичность (диспепсия, тошнота и рвота, пептические язвы, желудочные кровотечения), поэтому препараты данной группы принимаются во время еды, а иногда требуется их совместное применение с антацидами или блокаторами Н2-гистаминовых рецепторов. При назначении наркотических анальгетиков наиболее часто наблюдается седативный эффект, угнетение дыхания, запоры, тошнота и рвота. Может развиваться также миоклония, миоз, сухость во рту, зуд, дисфория, в старческом возрасте возможны галлюцинаций.
Седативный эффект наиболее выражен первые дни после начала приема опиатов, уменьшаясь в ходе лечения. Тем не менее, при хорошем анальгезирующем эффекте возможно снижение дозы наркотического анальгетика на 25% для уменьшения седации. Угнетение дыхания является наиболее серьезным осложнением лечения наркотическими анальгетиками. В этом случае показано назначение препаратов-антагонистов (налоксон), что позволяет восстановить функцию дыхания, но может привести с развитию синдрома «отдачи». Запоры — самый частый из побочных эффектов приема опиатов. Наиболее выражены в старческом возрасте и в случаях гиподинамии. Рекомендуется назначение слабительных средств, употребление в пищу грубой растительной клетчатки. Иногда полезным оказывается назначение препаратов, влияющих на моторику гладкой мускулатуры желудочно-кишечного тракта (метоклопрамид). Клизмы следует применять с осторожностью. В случае развития запора у онкологических больных необходимо помнить о возможности механической кишечной непроходимости. Тошнота и рвота наблюдаются примерно у 50% больных, принимающих морфин внутрь. Эти явления купируются применением антиэметиков (метоклопрамиддиазепам, ондансетрон). Сопутствующая терапия. Антидепрессанты (амитриптилин, доксепин, имипрамин) оказывают анальгезирующий эффект при болевом синдроме, связанном как с непосредственным поражением нервов, так и с различными нейропатиями. Применяются в меньших дозах, чем в психиатрической практике, оказывают «морфинсберегающее» действие/позволяй за счет синергизма уменьшать Дозу Опиатов. Назначаемые на ночь препараты способствуют нормализации сна у больных с хроническим болевым синдромом, могут усиливать седативный эффект наркотических анальгетиков.
Антйконвульсанты (карбамазепин, клоназепам) назначают также при болях, связанных с нейропатиями, особенно прй болях «стреляющего» характера. Могут усиливать седативный эффект опиатов, вызывать угнётение функции костного мозга.
Кортикостероиды (преднизалон, дексаметазон) даже в малых дозах способны повышать аппетит, настроение, а также оказывают антиэметический эффект. В больших дозах применяются при костных болях, остром сдавлений спинного мозга,, повышении внутричерепного давления, висцеральных болях. Побочные эффекты, как правило, могут развиться лишь при длительном приеме в больших дозах. . Нейролептики (галоперидол, дроперидол, флуфеназин), помимо седативного эффекта, оказывают анальгезирующий эффект при нейропатиях, обладают «морфинсберегающим» действием, а также являются эффективным противорвотным средством. Могут вызывать сухость во рту и экстрапирамидные расстройства. Бензодиазепины (диазепам) обладают анксиолитическим действием, способствуют нормализации сна у больных с хроническим болевым синдромом. Обладают противорвотным эффектом. Могут усиливать седативное действие наркотических анальгетиков.
Местные анестетики применяются, как правило, для блокады нервных окончаний, стволов,- сплетений, а иногда — и для спинальной блокады. Немедикаментозные мероприятия. К физическим способам воздействия относят кожную стимуляцию (точечным массаж* применение холода), специальные комплексы лечебной физкультуры, иммобилизацию. Применяют также акупунктуру и чрескожную электростимуляцию нервов. Следует помнить о необходимости психологического воздействия на больного с хроническим болевым синдромом, включая сеансы психотерапии и образовательные мероприятия (как в форме бесед, так и в виде печатной информации).
