АКТУАЛЬНОСТЬ ВОПРОСА
Одно из последних достижений науки — создание вакцины, предотвращающей возникновение рака шейки матки (РШМ), рака вульвы и влагалища, а также генитальных кондилом, которые, как известно, вызываются определёнными типами вируса папилломы человека (ВПЧ), поражающими эпителий слизистых и кожи аногенитальной зоны. Развитие РШМ непосредственно связано с первистенцией высокоонкогенных типов ВПЧ в эпителии (в 99,7% случаев этого заболевания из образцов опухолей выделяли ДНК ВПЧ). В Европе и РФ наиболее часто встречаются типы 16, 18, 31, 45. Исследования показали, что на протяжении жизни данным вирусом заражается большинство женщин. До 82% женщин заражаются ВПЧ уже через 2 года после начала половой жизни. Даже при одном партнёре 20% женщин являются заражёнными вирусом. В большинстве случаев со временем вирус элиминируется из организма самостоятельно, но у части женщин отмечается его носительство. Особенность инфекции заключается в том, что изза тропности вируса к эпителию его невозможно обнаружить в крови, а выработка АТ иммунной системой возникает лишь в половине случаев заражения. При этом уровень АТ очень низок и не способен обеспечить длительную надёжную защиту от развития заболевания. ДНК ВПЧ сохраняется в эпителии долгое время, а при воздействии факторов риска может привести к развитию предракового состояния, РШМ, рака вульвы, влагалища, анального рака и других органов. Международная организация по исследованиям в области рака (IARC) заявляет, что предотвращение заражения и персистенции ВПЧ опрелённо можно считать необходимым для профилактики РШМ, то есть вакцина против ВПЧ может является вакциной против РШМ. Однако как ВОЗ, так и Комитет по Вакцинам FDA рекомендуют (как условие лицензирования вакцин против РШМ) в дизайне исследований III фазы для ВПЧ вакцин с высокой точностью показывать эффективность не в отношении инфицирования/персистирующей ВПЧ инфекции, а в отношении CIN 2/3 и аденокарциномы in situ (AIS) как облигатных и непосредственных прекурсоров инвазивного рака. Более того, учитывая тот факт, что онкогенные типы ВПЧ не менее чем в половине случаев являются причиной рака влагалища и вульвы, анального рака, а также пениса у мужчин, ВПЧ вакцина может обеспечить их реальную профилактику. Кроме злокачественной патологии, которая является ниаболее опасным следствием персистенции вируса папилломы онкогенных типов, существует целый ряд других заболеваний генитальной и негенитальной областей, также обусловленных ВПЧ, но низкого онкогенного риска (преимущественно типами 6 и 11), таких, как экзофитные кондиломы, субклинические формы инфекции гениталий, цервикальная интраэпителиальная неоплазия низкой степени, рецидивирующий респираторный папилломатоз у детей и взрослых и т.д.. В большинстве случаев такой генитальной патологии требуется деструктивное лечение, нередко неэффективное, требующее значительных финансовых затрат и вызывающее у женщин чувство тревоги, а также снижение самооценки и качества жизни в целом. Рецидивирующий респираторный папилломатоз же, не являясь онкологической патологией, требует постоянного хирургического удаления папиллом и, к сожалению, нередко приводит к летальным исходам у детей вследствие обструкции верхних дыхательных путей.
КЛАССИФИКАЦИЯ
В настоящее время проводят исследования по созданию терапевтических вакцин, нацеленных на онкобелки Е6 и Е7 ВПЧ. Терапевтическая вакцина необходима для того, чтобы помочь иммунной системе разрушить вирус, а также индуцировать клеточный иммунный ответ, направленный на элиминацию атипически изменённых клеток. Необходима эффективная вакцина и при наличии предракового состояния или даже ракового заболевания. Однако пока реальных результатов не получено. Наибольшие успехи достигнуты в создании профилактической вакцины. Профилактические вакцины против разных типов ВПЧ ( в зависимости от вакцинных типов, входящих в их состав) — метод первичной профилактики РШМ, экзофитных кондилом, заболеваний вульвы, влагалища, пениса и, возможно, части анальных карцином. Создание профилактических вакцин — большое достижение современной медицины. Первая в мире квадривалентная вакцина (ВПЧ 16, 18, 6,11) зарегестрирована за 13 месяцев в 80 странах мира, включая РФ, внесена в Национальные календари иммунизации многих стран, утверждена для тотальной профилактической вакцинации девочек 10-11 лет в США, девочек и женщин от 9 до 26 лет в Австралии и подростков (мальчиков и девочек 12-15 лет) большинства стран Евросоюза. Бивалентная вакцина (ВПЧ 16 и 18) зарегистрирована в Австралии. Данные вакцины призваны помогать иммунной системе распознать и разрушить ВПЧ на ранней стадии контакта с возбудителем, тем самым предотвратить развитие клинических симптомов при инфицировании и обеспечить элиминацию из организма клеток, пораженных вирусом.
МЕХАНИЗМ ДЕЙСТВИЯ И ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ
Процесс создания вакцины против ВПЧ чрезвычайно сложен, поскольку невозможно размножение и выращивание этого вируса в искусственных условиях, в связи с чем его изучение затруднено. Мишень реализации превентивного эффекта вакцины — капсидный белок ВПЧ L1. Как известно, вирус имеет сферическую поверхность, состоит из 72-х пентамеров, состоящих из 360 копий капсидного белка L1 и 12 копий капсидного белка L2 (так называемых поздних — от английского слова late). Белок L1 — главный компонент капсида. Капсидные белки образуют оболочку вируса, охватывающую вирусную ДНК.
После инфицирования эпителия вирусом папилломы в его верхних слоях отмечается продукция большого количества поздних капсидных белков, формирующих оболочку вируса, в которую упаковывается вирусная ДНК. Таким образом, образуются большое количество новых вирионов, что характеризует начальную, продуктивную фазу вирусной инфекции. Наибольшей иммуногенностью обладают поздние капсидные белки L1 и L2. Поэтому белок L2, преобладающий в капсиде, был избран мишенью для создания профилактической вакцины, призванной затормозить продукцию ВПЧ и предотвратить образование критической концентрации для возникновения заболевания (рис. 13-1).
Одно из последних достижений науки — создание вакцины, предотвращающей возникновение рака шейки матки (РШМ), рака вульвы и влагалища, а также генитальных кондилом, которые, как известно, вызываются определёнными типами вируса папилломы человека (ВПЧ), поражающими эпителий слизистых и кожи аногенитальной зоны. Развитие РШМ непосредственно связано с первистенцией высокоонкогенных типов ВПЧ в эпителии (в 99,7% случаев этого заболевания из образцов опухолей выделяли ДНК ВПЧ). В Европе и РФ наиболее часто встречаются типы 16, 18, 31, 45. Исследования показали, что на протяжении жизни данным вирусом заражается большинство женщин. До 82% женщин заражаются ВПЧ уже через 2 года после начала половой жизни. Даже при одном партнёре 20% женщин являются заражёнными вирусом. В большинстве случаев со временем вирус элиминируется из организма самостоятельно, но у части женщин отмечается его носительство. Особенность инфекции заключается в том, что изза тропности вируса к эпителию его невозможно обнаружить в крови, а выработка АТ иммунной системой возникает лишь в половине случаев заражения. При этом уровень АТ очень низок и не способен обеспечить длительную надёжную защиту от развития заболевания. ДНК ВПЧ сохраняется в эпителии долгое время, а при воздействии факторов риска может привести к развитию предракового состояния, РШМ, рака вульвы, влагалища, анального рака и других органов. Международная организация по исследованиям в области рака (IARC) заявляет, что предотвращение заражения и персистенции ВПЧ опрелённо можно считать необходимым для профилактики РШМ, то есть вакцина против ВПЧ может является вакциной против РШМ. Однако как ВОЗ, так и Комитет по Вакцинам FDA рекомендуют (как условие лицензирования вакцин против РШМ) в дизайне исследований III фазы для ВПЧ вакцин с высокой точностью показывать эффективность не в отношении инфицирования/персистирующей ВПЧ инфекции, а в отношении CIN 2/3 и аденокарциномы in situ (AIS) как облигатных и непосредственных прекурсоров инвазивного рака. Более того, учитывая тот факт, что онкогенные типы ВПЧ не менее чем в половине случаев являются причиной рака влагалища и вульвы, анального рака, а также пениса у мужчин, ВПЧ вакцина может обеспечить их реальную профилактику. Кроме злокачественной патологии, которая является ниаболее опасным следствием персистенции вируса папилломы онкогенных типов, существует целый ряд других заболеваний генитальной и негенитальной областей, также обусловленных ВПЧ, но низкого онкогенного риска (преимущественно типами 6 и 11), таких, как экзофитные кондиломы, субклинические формы инфекции гениталий, цервикальная интраэпителиальная неоплазия низкой степени, рецидивирующий респираторный папилломатоз у детей и взрослых и т.д.. В большинстве случаев такой генитальной патологии требуется деструктивное лечение, нередко неэффективное, требующее значительных финансовых затрат и вызывающее у женщин чувство тревоги, а также снижение самооценки и качества жизни в целом. Рецидивирующий респираторный папилломатоз же, не являясь онкологической патологией, требует постоянного хирургического удаления папиллом и, к сожалению, нередко приводит к летальным исходам у детей вследствие обструкции верхних дыхательных путей.
КЛАССИФИКАЦИЯ
В настоящее время проводят исследования по созданию терапевтических вакцин, нацеленных на онкобелки Е6 и Е7 ВПЧ. Терапевтическая вакцина необходима для того, чтобы помочь иммунной системе разрушить вирус, а также индуцировать клеточный иммунный ответ, направленный на элиминацию атипически изменённых клеток. Необходима эффективная вакцина и при наличии предракового состояния или даже ракового заболевания. Однако пока реальных результатов не получено. Наибольшие успехи достигнуты в создании профилактической вакцины. Профилактические вакцины против разных типов ВПЧ ( в зависимости от вакцинных типов, входящих в их состав) — метод первичной профилактики РШМ, экзофитных кондилом, заболеваний вульвы, влагалища, пениса и, возможно, части анальных карцином. Создание профилактических вакцин — большое достижение современной медицины. Первая в мире квадривалентная вакцина (ВПЧ 16, 18, 6,11) зарегестрирована за 13 месяцев в 80 странах мира, включая РФ, внесена в Национальные календари иммунизации многих стран, утверждена для тотальной профилактической вакцинации девочек 10-11 лет в США, девочек и женщин от 9 до 26 лет в Австралии и подростков (мальчиков и девочек 12-15 лет) большинства стран Евросоюза. Бивалентная вакцина (ВПЧ 16 и 18) зарегистрирована в Австралии. Данные вакцины призваны помогать иммунной системе распознать и разрушить ВПЧ на ранней стадии контакта с возбудителем, тем самым предотвратить развитие клинических симптомов при инфицировании и обеспечить элиминацию из организма клеток, пораженных вирусом.
МЕХАНИЗМ ДЕЙСТВИЯ И ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ
Процесс создания вакцины против ВПЧ чрезвычайно сложен, поскольку невозможно размножение и выращивание этого вируса в искусственных условиях, в связи с чем его изучение затруднено. Мишень реализации превентивного эффекта вакцины — капсидный белок ВПЧ L1. Как известно, вирус имеет сферическую поверхность, состоит из 72-х пентамеров, состоящих из 360 копий капсидного белка L1 и 12 копий капсидного белка L2 (так называемых поздних — от английского слова late). Белок L1 — главный компонент капсида. Капсидные белки образуют оболочку вируса, охватывающую вирусную ДНК.
После инфицирования эпителия вирусом папилломы в его верхних слоях отмечается продукция большого количества поздних капсидных белков, формирующих оболочку вируса, в которую упаковывается вирусная ДНК. Таким образом, образуются большое количество новых вирионов, что характеризует начальную, продуктивную фазу вирусной инфекции. Наибольшей иммуногенностью обладают поздние капсидные белки L1 и L2. Поэтому белок L2, преобладающий в капсиде, был избран мишенью для создания профилактической вакцины, призванной затормозить продукцию ВПЧ и предотвратить образование критической концентрации для возникновения заболевания (рис. 13-1).
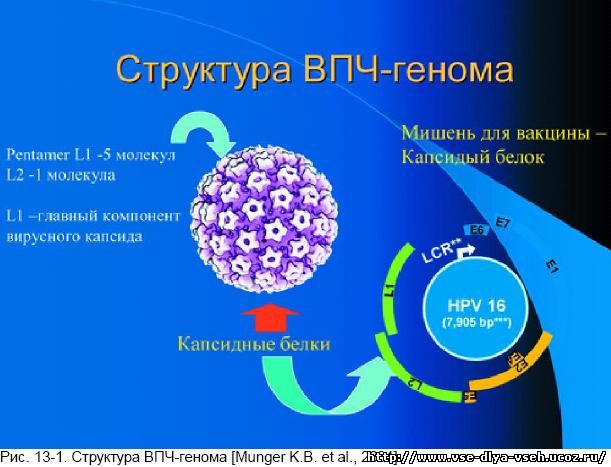
Рис. 13-1. Структура ВПЧ-генома [Munger K.B. et al., 2004].
Механизмы иммунных реакций человеческого организма известны. Принципы вакцинации основаны на двух главных характеристиках адаптивного иммунитета: специфичности и иммунологической (клеточной) памяти. Иммунитет против ВПЧ является типоспецифическим или приобретённым в процессе контакта с инфекционным агентом. Введение вакцины приводит к стимуляции выработки АТ, причём в нейтрализации вируса принимают участи только нейтрализующие антитела, т.е. специальные протеины, цель которых — распознавание и нейтрализация конкретных чужеродных белков (антигенов). Синтез АТ происходит в Влимфоцитах, имеющих ограниченную по продолжительности жизнь, поэтому стимуляция клеточной памяти — чрезвычайно важный компонент вакцинации. Благодаря клеточной памяти в дальнейшем контакт с Аг возбудителя запустит процесс новой выработки нейтрализующих АТ, что необходимо для создания долговременного иммунитета. Контакт с Аг приводит к созданию комплекса «Аг+АТ». Цитотоксические клетки организма (в том числе макрофаги) легко распознают данный комплекс, происходит разрушение поражённой клетки, лизинг и выведение из организма вместе с генным материалом ВПЧ. Помимо Аг в вакцину обычно вводят веществаадъюванты (например, соли алюминия, используемые во многих современных вакцинах), значительно усиливающие иммунный ответ. В настоящее время учёные продолжают разработку более специфичных и эффективных адъювантов. Революционная веха в истории создания вакцины против ВПЧ — изобретение австралийскими учёными рекомбинантной вирусоподобной частицы, синтезированной искусственным путём. Данная рекомбинантная вирусоподобная частица не содержит геномного материала (ДНК ВПЧ). Вирусоподобная частица, в данной вакцине выполняющая функцию Аг, создана путём экзогенной экспрессии белка L1 в различных клеточных средах (дрожжи, бактерии, клетки насекомых и др.). Она представляет собой "пустую” белковую оболочку, не инфекционна, при электронной микроскопии не отличима от вириона ВПЧ, не способна вызвать инфицирование папилломавирусом, однако успешно стимулирует продукцию нейтрализующих антител, которые впоследствии связываются с капсидом ВПЧ при инфицировании.
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ РАЗЛИЧНЫХ ВИДОВ ВАКЦИН ПРОТИВ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА
Предварительные испытания, проведённые на животных, инфицированных вирусом папилломы, доказали способность ВПЧвакцин стимулировать образование АТ. Положительный преклинический результат in vivo тестирования послужил основой для дальнейшей разработки и клинической оценки кандидатных вакцин против ВПЧ 16, 18, 6 и 11 типов. Сегодня статус ВПЧ вакцин, разработка которых началась в 80е годы, различен: по квадривалентной вакцине завершены клинические исследования II и III фазы, проводятся исследования IV фазы; по бивалентной — завершена II стадия и проводится III стадия клинических испытаний. Было показано, что вакцина вызывает образование иммуноглобулинов к белку L1 вируса папилломы, в эпителии генитального тракта и в крови отмечают в течение длительного времени высокое содержание иммуноглобулинов. Клинические испытания на людяхдобровольцах начались с 90х гг. На первом этапе были сделаны уточнения дозировок и сравнение комбинированных вакцин с моновалентной вакциной. Были предложены различные адъюванты, получены первые доказательства эффективности и приемлемости вакцин в небольших популяциях. Проведённые испытания позволили оценить иммуногенность разных вакцин, а также изучить скорость антителообразования после введения каждой из трёх доз вакцин и оценить титры АТ. Первоначальные данные послужили базой для проведения широкомасштабных плацебоконтролируемых клинических испытаний не только у женщин различных возрастных групп, но и у мужчин (квадривалентная вакцина) и подростков. За прошедшее время отмечены значительные успехи в усовершенствовании вакцин, получены доказательства их эффективности и безопасности. В настоящее время максимальный срок наблюдения в испытаниях составляет более 5 лет (квадривалентная вакцина). Продолжают испытания на женщинах более старшего возраста (в том числе инфицированных ВПЧ или имеющих ВПЧ ассоциированные заболевания), а также на мужчинах и мальчиках. Получена информация о результатах испытания трёх видов вакцин:
●Моновалентная вакцина направлена против ВПЧ 16 типа. Данная вакцина была предложена первой. Содержит адъювант алюминия — гидроксифосфата сульфат аморфный. Предварительные данные клинических исследований, проведённые на группе из 2392 женщин 16–23 лет, были опубликованы в 2002 г. Эффективность вакцины против персистирующей инфекции составила 100%. Поскольку в данном исследовании исследовался монокомпонент ВПЧ 16 квадривалентной вакцины для доказательства принципа действия, в дальнейшем исследовалась уже только квадривалентная вакцина.
●Квадривалентная вакцина направлена против 4х типов ВПЧ (16, 18, 6, 11). Содержит адъювант алюминия — гидроксифосфата сульфат аморфный. В клинических исследованиях (более 25 000 участников) вакцина показала 100% эффективность в профилактике не только РШМ, но и рака вульвы и влагалища, а также 99% эффективность в профилактике генитальных кондилом. Зарегистрирована для применения у детей и подростков обоего пола от 9 до 17 лет и молодых женщин от 18 до 26 лет.
●Бивалентная вакцина направлена против ВПЧ 16 и 18 типов. Содержит адъювант алюминия — гидроксид с монофосфорилом липида А. Впервые полученные результаты были опубликованы в 2004 г. Испытания проводили на группе из 1113 женщин 15–25 лет. Эффективность вакцины составила 100%. В клинических испытаниях вакцин, проведённых в последние годы и проводимых в настоящее время, приняло участие уже более 60 тысяч человек. Испытания позволяют дать сравнительную оценку эффективности прпепарата с группой плацебо по следующим параметрам:
●Эффективность предотвращения:
♦персистенции ПВИ;
♦развития ЦИН I–III степени и аднокарционмы in situ;
♦развития дисплазии вульвы II–III степени;
♦развития дисплазии влагалища II–III степени;
♦развития генитальных кондилом.
●Иммуногенность — оценка уровня антителообразования при использовании разных адъювантов, подсчёт титра АТ.
●Безопасность:
♦побочные эффекты;
♦осложнения;
♦влияние на беременность;
♦влияние на лактацию;
♦влияние на состояние здоровья.
КВАДРИВАЛЕНТНАЯ ВАКЦИНА ГАРДАСИЛ©
В настоящее время уже более чем в 50 странах мира зарегистрирована квадривалентная вакцина против ВПЧ компании MSD (Мерк Шарп и Доум) — гардасил©. Вакцина предотвращает развитие РШМ, рака вульвы, влагалища, ЦИН I– III степени, дисплазий вульвы, влагалища II–III степеней и экзофитных генитальных кондилом, вызываемых ВПЧ 16, 18, 6, 11 типов. Вакцина доступна для практического врача во многих странах, в том числе и в РФ, входит в Национальный календарь вакцинации подростков в США, Австралии и большинстве стран Евросоюза.
Вакцина содержит Аг в следующих дозах:
●20 мкг — Аг ВПЧ 6го типа;
●40 мкг — Аг ВПЧ 11го типа;
●40 мкг — Аг ВПЧ 16го типа;
●20 мкг — Аг ВПЧ 18го типа.
Адъювант — 225 мкг аморфного алюминия гидроксифосфата сульфата производства MSD. При создании данной вакцины в качестве системы экспрессии использовали клетки дрожжей. Период наблюдения за результатами применения вакцины на крупных популяциях составил уже более 5 лет. Схема вакцинации: вакцина вводится трёхкратно внутримышечно в дельтовидную мышцу руки. Инъекции вводили повторно по схеме 0–2–6 мес. Иммуногенность вакцины чрезвычайно высока и через месяц после 3 инъекции сероконверсия определялась практически у 100% пациенток. Вакцина гардасил© изучена также при одновременном введении с рекомбинантной вакциной против гепатита В: было показано, что одновременное введение обеих вакцин (в разные руки) не влияло на показатели их эффективности, что послужило основанием к разрешению одновременной вакцинации этими вакцинами. В программе клинических исследований вакцины гардасил© для оценки клинической эффективности в отношении онкологических заболеваний были использованы утвержденные ВОЗ и FDA клинические суррогатные конечные точки: предрак шейки матки (вульвы, влагалища) и аденокарцинома in situ. Эффективность против развития ЦИН 2/3 составила 100% (табл. 13-1). Так, в группе из 8460 женщин, получавших плацебо в период от 2 до 4 лет, зарегистрировано 53 случая цервикальной неоплазии. В группе вакцинированных не было обнаружено ни одного случая. Таблица 13-1. Комбинированный анализ исследований II/III фазы вакцины гардасил©: основной анализ эффективности. Средняя продолжительность наблюдения составила 4, 3 и 2 года, в зависимости от исследования
Механизмы иммунных реакций человеческого организма известны. Принципы вакцинации основаны на двух главных характеристиках адаптивного иммунитета: специфичности и иммунологической (клеточной) памяти. Иммунитет против ВПЧ является типоспецифическим или приобретённым в процессе контакта с инфекционным агентом. Введение вакцины приводит к стимуляции выработки АТ, причём в нейтрализации вируса принимают участи только нейтрализующие антитела, т.е. специальные протеины, цель которых — распознавание и нейтрализация конкретных чужеродных белков (антигенов). Синтез АТ происходит в Влимфоцитах, имеющих ограниченную по продолжительности жизнь, поэтому стимуляция клеточной памяти — чрезвычайно важный компонент вакцинации. Благодаря клеточной памяти в дальнейшем контакт с Аг возбудителя запустит процесс новой выработки нейтрализующих АТ, что необходимо для создания долговременного иммунитета. Контакт с Аг приводит к созданию комплекса «Аг+АТ». Цитотоксические клетки организма (в том числе макрофаги) легко распознают данный комплекс, происходит разрушение поражённой клетки, лизинг и выведение из организма вместе с генным материалом ВПЧ. Помимо Аг в вакцину обычно вводят веществаадъюванты (например, соли алюминия, используемые во многих современных вакцинах), значительно усиливающие иммунный ответ. В настоящее время учёные продолжают разработку более специфичных и эффективных адъювантов. Революционная веха в истории создания вакцины против ВПЧ — изобретение австралийскими учёными рекомбинантной вирусоподобной частицы, синтезированной искусственным путём. Данная рекомбинантная вирусоподобная частица не содержит геномного материала (ДНК ВПЧ). Вирусоподобная частица, в данной вакцине выполняющая функцию Аг, создана путём экзогенной экспрессии белка L1 в различных клеточных средах (дрожжи, бактерии, клетки насекомых и др.). Она представляет собой "пустую” белковую оболочку, не инфекционна, при электронной микроскопии не отличима от вириона ВПЧ, не способна вызвать инфицирование папилломавирусом, однако успешно стимулирует продукцию нейтрализующих антител, которые впоследствии связываются с капсидом ВПЧ при инфицировании.
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ РАЗЛИЧНЫХ ВИДОВ ВАКЦИН ПРОТИВ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА
Предварительные испытания, проведённые на животных, инфицированных вирусом папилломы, доказали способность ВПЧвакцин стимулировать образование АТ. Положительный преклинический результат in vivo тестирования послужил основой для дальнейшей разработки и клинической оценки кандидатных вакцин против ВПЧ 16, 18, 6 и 11 типов. Сегодня статус ВПЧ вакцин, разработка которых началась в 80е годы, различен: по квадривалентной вакцине завершены клинические исследования II и III фазы, проводятся исследования IV фазы; по бивалентной — завершена II стадия и проводится III стадия клинических испытаний. Было показано, что вакцина вызывает образование иммуноглобулинов к белку L1 вируса папилломы, в эпителии генитального тракта и в крови отмечают в течение длительного времени высокое содержание иммуноглобулинов. Клинические испытания на людяхдобровольцах начались с 90х гг. На первом этапе были сделаны уточнения дозировок и сравнение комбинированных вакцин с моновалентной вакциной. Были предложены различные адъюванты, получены первые доказательства эффективности и приемлемости вакцин в небольших популяциях. Проведённые испытания позволили оценить иммуногенность разных вакцин, а также изучить скорость антителообразования после введения каждой из трёх доз вакцин и оценить титры АТ. Первоначальные данные послужили базой для проведения широкомасштабных плацебоконтролируемых клинических испытаний не только у женщин различных возрастных групп, но и у мужчин (квадривалентная вакцина) и подростков. За прошедшее время отмечены значительные успехи в усовершенствовании вакцин, получены доказательства их эффективности и безопасности. В настоящее время максимальный срок наблюдения в испытаниях составляет более 5 лет (квадривалентная вакцина). Продолжают испытания на женщинах более старшего возраста (в том числе инфицированных ВПЧ или имеющих ВПЧ ассоциированные заболевания), а также на мужчинах и мальчиках. Получена информация о результатах испытания трёх видов вакцин:
●Моновалентная вакцина направлена против ВПЧ 16 типа. Данная вакцина была предложена первой. Содержит адъювант алюминия — гидроксифосфата сульфат аморфный. Предварительные данные клинических исследований, проведённые на группе из 2392 женщин 16–23 лет, были опубликованы в 2002 г. Эффективность вакцины против персистирующей инфекции составила 100%. Поскольку в данном исследовании исследовался монокомпонент ВПЧ 16 квадривалентной вакцины для доказательства принципа действия, в дальнейшем исследовалась уже только квадривалентная вакцина.
●Квадривалентная вакцина направлена против 4х типов ВПЧ (16, 18, 6, 11). Содержит адъювант алюминия — гидроксифосфата сульфат аморфный. В клинических исследованиях (более 25 000 участников) вакцина показала 100% эффективность в профилактике не только РШМ, но и рака вульвы и влагалища, а также 99% эффективность в профилактике генитальных кондилом. Зарегистрирована для применения у детей и подростков обоего пола от 9 до 17 лет и молодых женщин от 18 до 26 лет.
●Бивалентная вакцина направлена против ВПЧ 16 и 18 типов. Содержит адъювант алюминия — гидроксид с монофосфорилом липида А. Впервые полученные результаты были опубликованы в 2004 г. Испытания проводили на группе из 1113 женщин 15–25 лет. Эффективность вакцины составила 100%. В клинических испытаниях вакцин, проведённых в последние годы и проводимых в настоящее время, приняло участие уже более 60 тысяч человек. Испытания позволяют дать сравнительную оценку эффективности прпепарата с группой плацебо по следующим параметрам:
●Эффективность предотвращения:
♦персистенции ПВИ;
♦развития ЦИН I–III степени и аднокарционмы in situ;
♦развития дисплазии вульвы II–III степени;
♦развития дисплазии влагалища II–III степени;
♦развития генитальных кондилом.
●Иммуногенность — оценка уровня антителообразования при использовании разных адъювантов, подсчёт титра АТ.
●Безопасность:
♦побочные эффекты;
♦осложнения;
♦влияние на беременность;
♦влияние на лактацию;
♦влияние на состояние здоровья.
КВАДРИВАЛЕНТНАЯ ВАКЦИНА ГАРДАСИЛ©
В настоящее время уже более чем в 50 странах мира зарегистрирована квадривалентная вакцина против ВПЧ компании MSD (Мерк Шарп и Доум) — гардасил©. Вакцина предотвращает развитие РШМ, рака вульвы, влагалища, ЦИН I– III степени, дисплазий вульвы, влагалища II–III степеней и экзофитных генитальных кондилом, вызываемых ВПЧ 16, 18, 6, 11 типов. Вакцина доступна для практического врача во многих странах, в том числе и в РФ, входит в Национальный календарь вакцинации подростков в США, Австралии и большинстве стран Евросоюза.
Вакцина содержит Аг в следующих дозах:
●20 мкг — Аг ВПЧ 6го типа;
●40 мкг — Аг ВПЧ 11го типа;
●40 мкг — Аг ВПЧ 16го типа;
●20 мкг — Аг ВПЧ 18го типа.
Адъювант — 225 мкг аморфного алюминия гидроксифосфата сульфата производства MSD. При создании данной вакцины в качестве системы экспрессии использовали клетки дрожжей. Период наблюдения за результатами применения вакцины на крупных популяциях составил уже более 5 лет. Схема вакцинации: вакцина вводится трёхкратно внутримышечно в дельтовидную мышцу руки. Инъекции вводили повторно по схеме 0–2–6 мес. Иммуногенность вакцины чрезвычайно высока и через месяц после 3 инъекции сероконверсия определялась практически у 100% пациенток. Вакцина гардасил© изучена также при одновременном введении с рекомбинантной вакциной против гепатита В: было показано, что одновременное введение обеих вакцин (в разные руки) не влияло на показатели их эффективности, что послужило основанием к разрешению одновременной вакцинации этими вакцинами. В программе клинических исследований вакцины гардасил© для оценки клинической эффективности в отношении онкологических заболеваний были использованы утвержденные ВОЗ и FDA клинические суррогатные конечные точки: предрак шейки матки (вульвы, влагалища) и аденокарцинома in situ. Эффективность против развития ЦИН 2/3 составила 100% (табл. 13-1). Так, в группе из 8460 женщин, получавших плацебо в период от 2 до 4 лет, зарегистрировано 53 случая цервикальной неоплазии. В группе вакцинированных не было обнаружено ни одного случая. Таблица 13-1. Комбинированный анализ исследований II/III фазы вакцины гардасил©: основной анализ эффективности. Средняя продолжительность наблюдения составила 4, 3 и 2 года, в зависимости от исследования
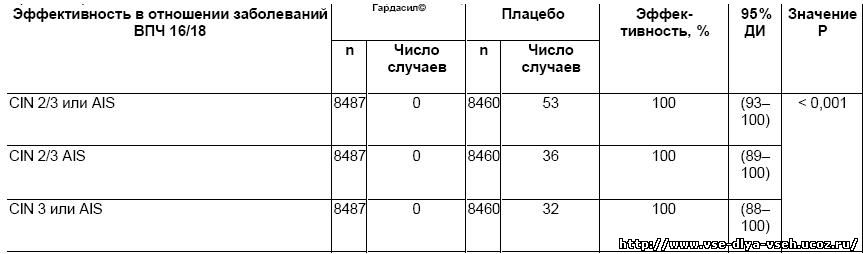
ВПЧ — вирус папилломы человека; CIN — цервикальная интраэпитальная неоплазия, AIS — аденокарцинома in situ, n — количество человек в группе; ДИ — доверительный интервал. В ходе исследования было отмечено, что вакцина гардасил© даёт выраженный протективный эффект от вульварного и вагинального предракового состояния. Так, в группе из 8667 женщин, получавших плацебо, зарегистрировано 24 случая указанной патологии, а в группе из 8641 вакцинированных женщин не было отмечено ни одного случая вагинальной или вульварной неоплазии 2/3. Отмечена практически полная защита от развития генитальных кондилом, вызванных входящими в состав вакцины 6 и 11 типами ВПЧ, против которых активна вакцина. Высочайшая клиническая эффективность и безопасность вакцины гардасил© подтвердил совокупный анализ 4-х рандомизированных плацебоконтролируемых клинических испытаний, выполняемых в соответствии с II и III фазами. В испытаниях участвовало 20 887 женщин в возрасте от 16 до 26 лет. Частота местных и общих побочных эффектов не превысила 1% и была выше, чем в группе плацебо. Важно отметить, что включение в клинические исследования производилось независимо от исходного ВПЧ-статуса. На Международной консенсусконференции по ВПЧ в 2006 г. были представлены данные о том, что вакцина гардасил© нейтрализовала 2 дополнительных онкогенных штамма ВПЧ — 31-й и 45-й. Исследования вакцины в данном направлении продолжаются. Вакцина гардасил© отнесена к категории В по беременности, так как не обнаружено негативного влияния вакцины на фертильность, беременность или плод. Её разрешено вводить кормящим женщинам. На сегодня уже имеются свидетельства наличия иммунологической памяти при вакцинации квадривалентной вакциной. Продолжаются также клинические исследования квадривалентной вакцины у женщин старше 26–45 лет и у молодых мужчин.
БИВАЛЕНТНАЯ ВАКЦИНА ЦЕРВАРИКС
В РФ поданы документы для регистрации бивалентной вакцины против 16-го и 18-го типов — церварикс (компания GSK — ГлаксоСмитКляйн). Результаты исследования данной вакцины опубликованы после 5 лет применения. В настоящее время вакцина зарегистрирована в Австралии.
Вакцина содержит Аг в следующих дозах:
●20 мкг — Аг ВПЧ 16-го типа;
●20 мкг — Аг ВПЧ 18-го типа.
Система экспрессии — клетки насекомых. Важное отличие от вакцины гардасил© (кроме отсутствия антигенов ВПЧ 6 и 11) — новый адъювант производства компании GSK. (500 мкг гидроксида алюминия плюс 50 мкг монофосфорил липида А, MPL®). Схема вакцинации: церварикс вводили внутримышечно в дельтовидную область руки. Инъекции вводили повторно по схеме 0–1–6 мес. Сероконверсия через 7 мес после вакцинации наблюдается у 100% женщин, через 5 лет наблюдения титр стойко сохраняется у 98% пациенток. Среднегеометрические титры АТ выше у молодых женщин. Данные клинических испытаний показали 100% эффективность вакцин для профилактики ЦИН и персистирующей ПВИ, вызванных вакцинными типами. В настоящее время проводят наблюдения за 18 000 женщин в возрасте от 15 до 25 лет, а также за 12 000 женщин в возрасте от 18 до 25 лет. Проводятся клинические испытания на женщинах старше 26 лет. Считается, что использование нового адьюванта в бивалентной вакцине обеспечит более высокую иммуногенность по сравнению с вакцинами, содержащими гидроксид алюминия: выше общий титр антител, который будет сохраняться дольше, хотя клиническая значимость более высоких уровней антител пока не установлена. Отмеченный общий уровень антител бивалентной вакцины в 16–26 раз выше, чем при естественном течении ПВИ. При использовании вакцины церварикс возникает перекрёстная реакция (табл. 13-2). Она позволяет считать, что происходит выработка АТ не только к 16 и 18 типам ВПЧ [АТ 16-го и 18-го типов ВПЧ обеспечивают защиту от 70% видов РШМ], но также к 31 и 45 типам ВПЧ. Пока показана эффективность в отношении транзиторного инфицирвоания. Возможно, данная вакцина позволяет предотвратить 80% всех цервикальных карцином. Таблица 13-2. Эффективность бивалентной вакцины церварикс против двух типов ВПЧ (Harper и соавт., 2006)
БИВАЛЕНТНАЯ ВАКЦИНА ЦЕРВАРИКС
В РФ поданы документы для регистрации бивалентной вакцины против 16-го и 18-го типов — церварикс (компания GSK — ГлаксоСмитКляйн). Результаты исследования данной вакцины опубликованы после 5 лет применения. В настоящее время вакцина зарегистрирована в Австралии.
Вакцина содержит Аг в следующих дозах:
●20 мкг — Аг ВПЧ 16-го типа;
●20 мкг — Аг ВПЧ 18-го типа.
Система экспрессии — клетки насекомых. Важное отличие от вакцины гардасил© (кроме отсутствия антигенов ВПЧ 6 и 11) — новый адъювант производства компании GSK. (500 мкг гидроксида алюминия плюс 50 мкг монофосфорил липида А, MPL®). Схема вакцинации: церварикс вводили внутримышечно в дельтовидную область руки. Инъекции вводили повторно по схеме 0–1–6 мес. Сероконверсия через 7 мес после вакцинации наблюдается у 100% женщин, через 5 лет наблюдения титр стойко сохраняется у 98% пациенток. Среднегеометрические титры АТ выше у молодых женщин. Данные клинических испытаний показали 100% эффективность вакцин для профилактики ЦИН и персистирующей ПВИ, вызванных вакцинными типами. В настоящее время проводят наблюдения за 18 000 женщин в возрасте от 15 до 25 лет, а также за 12 000 женщин в возрасте от 18 до 25 лет. Проводятся клинические испытания на женщинах старше 26 лет. Считается, что использование нового адьюванта в бивалентной вакцине обеспечит более высокую иммуногенность по сравнению с вакцинами, содержащими гидроксид алюминия: выше общий титр антител, который будет сохраняться дольше, хотя клиническая значимость более высоких уровней антител пока не установлена. Отмеченный общий уровень антител бивалентной вакцины в 16–26 раз выше, чем при естественном течении ПВИ. При использовании вакцины церварикс возникает перекрёстная реакция (табл. 13-2). Она позволяет считать, что происходит выработка АТ не только к 16 и 18 типам ВПЧ [АТ 16-го и 18-го типов ВПЧ обеспечивают защиту от 70% видов РШМ], но также к 31 и 45 типам ВПЧ. Пока показана эффективность в отношении транзиторного инфицирвоания. Возможно, данная вакцина позволяет предотвратить 80% всех цервикальных карцином. Таблица 13-2. Эффективность бивалентной вакцины церварикс против двух типов ВПЧ (Harper и соавт., 2006)

Примечание. Наблюдается перекрестный эффект против типов 45 и 31!!!
Бивалентная вакцина безопасна для девочек и молодых женщин, эффективно предотвращает развитие цервикальных неоплазий и персистенции ПВИ. Имеет место ряд побочных эффектов, свойственных практически любой вакцине:
●повышение температуры тела;
●появление кратковременного озноба;
●образование отёка, припухлости в месте инъекции;
●болезненность в месте инъекции;
●крапивница.
Ни одно испытание не показало значительной разницы в проявлении симптоматики при сравнении с группой плацебо (табл. 13-3). Общее число осложнений, спровоцированных вакцинацией, невелико. Таблица 13-3. Безопасность и переносимость вакцины церварикс
Бивалентная вакцина безопасна для девочек и молодых женщин, эффективно предотвращает развитие цервикальных неоплазий и персистенции ПВИ. Имеет место ряд побочных эффектов, свойственных практически любой вакцине:
●повышение температуры тела;
●появление кратковременного озноба;
●образование отёка, припухлости в месте инъекции;
●болезненность в месте инъекции;
●крапивница.
Ни одно испытание не показало значительной разницы в проявлении симптоматики при сравнении с группой плацебо (табл. 13-3). Общее число осложнений, спровоцированных вакцинацией, невелико. Таблица 13-3. Безопасность и переносимость вакцины церварикс

ВНЕДРЕНИЕ В ПРАКТИКУ ПРОФИЛАКТИЧЕСКОЙ ВАКЦИНАЦИИ
Как известно, комплексный подход к борьбе против РШМ включает различные виды воздействия — от первичной профилактики до раннего обнаружения, лечения и паллиативной терапии. Достигнуты определённые успехи в программах цитологического скрининга, в разработке усложнённых высокотехнологичных подходов с использованием ВПЧтеста, биомаркеров, жидкостной цитологии. ВОЗ продолжает разработку упрощённого подхода к раннему обнаружению предраковых состояний при помощи визуального осмотра шейки матки с использованием сосудистых тестов для регионов с низким уровнем доходов. Наблюдаемые результаты широкомасштабной вакцинации — реальное снижение заболеваемости и смертности от злокачественной патологии, ассоциированной с ВПЧ, по оценкам учёных, будут возможны не ранее чем через два десятилетия. Согласно результатам математического моделирования, внедрение вакцины в развитых странах позволит существенно снизить заболеваемость РШМ. Так, если провести вакцинацию 75–100% населения Германии, то заболеваемость РШМ через 15 лет снизится на 53–70%. По прогнозам исследователей, вакцинация не может подменить собой скрининговые программы, однако позволит значительно снизить заболеваемость и смертность от заболеваний, ассоциированных с ВПЧ, и сократить расходы здравоохранения за счёт увеличения интервала в скрининговых программах. В настоящее время единственная в РФ лицензированная вакцина Гардасил разрешена для использования у детей и подростков обоего пола с 9 до 17 лет и молодых женщин от 18 до 26 лет. Продолжающиеся исследования, надо надеяться, позволят ответить на многочисленные вопросы, касающиеся вакцинации, сегодня остающиеся неясными. Более зрелые женщины, как полагают, также могут получить профилактический эффект, но не во всех случаях одинаковый. Так, на модели квадривалентной вакцины было показано, что отмечалось снижение частоты заболеваний, ассоциированных с ВПЧвакцинных типов у женщин, которые на момент вакцинации были ВПЧпозитивны (ПЦР), но у которых ещё не была отмечена сероконверсия. Для ВПЧпозитивных женшин (ПЦР) при наличии сероконверсии это отмечено не было. Не выяснены пока и другие вопросы, в частности, о необходимости тотальной вакцинации мальчиков и мужчин. Данную вакцинацию некоторые исследователи считают целесообразной для создания коллективного иммунитета и защиты от генитальных кондилом. Не все специалисты разделяют эту точку зрения в связи с её экономическими аспектами. Неясны вопросы о вероятности замещения вакцинных типов вирусами других типов. Обсуждают также необходимость создания
мультивалентной вакцины. Следует ещё раз подчеркнуть, что указанные вакцины — средства профилактики, а не лечения.
ВНЕДРЕНИЕ ОБРАЗОВАТЕЛЬНЫХ ПРОГРАММ СРЕДИ ВРАЧЕЙ И НАСЕЛЕНИЯ
В связи с новыми знаниями о генитальной ПВИ и появлением профилактических вакцин против ВПЧ происходит пересмотр тактики ведения больных. Создание вакцин против ПВИ открывает новые возможности профилактики заболеваний, ассоциированных с данным возбудителем. Вакцины против ВПЧ могут служить отправной точкой при введении в действие разработанной ВОЗ «Глобальной стратегии профилактики и борьбы с инфекциями, передаваемыми половым путём: 2006– 2015 гг.». Программа вакцинации против ВПЧ даёт также возможность усилить профилактические меры против всех ИППП, так как в ходе её реализации подростков убеждают отложить начало половой жизни на более поздний срок или пользоваться презервативами. Вопросы внедрения вакцинации в практику тесно связаны с развитием образовательных программ как среди медицинского персонала, так и среди населения.
СПИСОК ЛИТЕРАТУРЫ
Всемирная Организация Здравоохранения. Подготовка к внедрению вакцин против вируса папилломы человека:
Руководство для стран по разработке политики и программ, 2007. www.who.int/reproductivehealth.
Прилепская В.Н. Профилактика рака шейки матки // Гинекология. — 2007. — № 1. — Т. 9. — С. 12–15.
Dubin G. Enhanced Immunogenicity of a Candidate Human Papillomavirus (HPV) 16/18 L1 Virus Like Particle (VLP) Vaccine with
Novel AS04 adjuvant in Preteens/Adolescents (submitted, 2005) 22.
Harper D.M., Franco E.L., Wheeler C. et al. // Lancet. — 2006. — Vol. 367. — P. 1247–1255.
Roden R. Wu TC. // Expert Rev Vaccines. — 2003. — Vol. 2. — P. 495–516.
Kirnbauer R., Booy F., Cheng N. et al. // Proc. Natl. Acad. Sci. USA. — 1992. — Vol. 89. — P. 12180–12184.
Kirnbauer R., Taub J., Greenstone H. et al. // J. Virol. — 1993. — Vol. 67. — P. 6929–6936.
Stanley M.A. Expert Rev Vaccines. — 2003. — Vol. 2. — P. 381–389.
Jansen K.U., Rosolowsky M., Schultz L.D. et al. // Vaccine. — 1995. — Vol. 13. — P. 1509–1514.
Bryan J.T., Jansen K.U., Lowe R.S. et al. // Med. Virol. — 1997. — Vol. 53. — P. 185–188.
Walboomers J.M., Jacobs M.V., Manos M.M. et al. // J. Pathol. — 1999. — Vol. 189. — P. 12–19.
Herrero R, Castellsagué X, Pawlita M. et al. // J. Natl. Cancer. Inst. — 2003. — Vol. 95. — P. 1772–1783.
World Health Organization. — Geneva, Switzerland: World Health Organization. — 1999. — P. 1–22.
Münger K., Baldwin A., Edwards K.M. et al. // J. Virol. — 2004. — Vol. 78. — P. 11451–11460.
Villa L.L. et al. // British Journ of cancer. — 2006. — Vol. 95. — P. 1459–66. Frazer J.H. et al. // The Pediatric Infectious Dis. J. — Vol. 25. — P. 65–81.
Как известно, комплексный подход к борьбе против РШМ включает различные виды воздействия — от первичной профилактики до раннего обнаружения, лечения и паллиативной терапии. Достигнуты определённые успехи в программах цитологического скрининга, в разработке усложнённых высокотехнологичных подходов с использованием ВПЧтеста, биомаркеров, жидкостной цитологии. ВОЗ продолжает разработку упрощённого подхода к раннему обнаружению предраковых состояний при помощи визуального осмотра шейки матки с использованием сосудистых тестов для регионов с низким уровнем доходов. Наблюдаемые результаты широкомасштабной вакцинации — реальное снижение заболеваемости и смертности от злокачественной патологии, ассоциированной с ВПЧ, по оценкам учёных, будут возможны не ранее чем через два десятилетия. Согласно результатам математического моделирования, внедрение вакцины в развитых странах позволит существенно снизить заболеваемость РШМ. Так, если провести вакцинацию 75–100% населения Германии, то заболеваемость РШМ через 15 лет снизится на 53–70%. По прогнозам исследователей, вакцинация не может подменить собой скрининговые программы, однако позволит значительно снизить заболеваемость и смертность от заболеваний, ассоциированных с ВПЧ, и сократить расходы здравоохранения за счёт увеличения интервала в скрининговых программах. В настоящее время единственная в РФ лицензированная вакцина Гардасил разрешена для использования у детей и подростков обоего пола с 9 до 17 лет и молодых женщин от 18 до 26 лет. Продолжающиеся исследования, надо надеяться, позволят ответить на многочисленные вопросы, касающиеся вакцинации, сегодня остающиеся неясными. Более зрелые женщины, как полагают, также могут получить профилактический эффект, но не во всех случаях одинаковый. Так, на модели квадривалентной вакцины было показано, что отмечалось снижение частоты заболеваний, ассоциированных с ВПЧвакцинных типов у женщин, которые на момент вакцинации были ВПЧпозитивны (ПЦР), но у которых ещё не была отмечена сероконверсия. Для ВПЧпозитивных женшин (ПЦР) при наличии сероконверсии это отмечено не было. Не выяснены пока и другие вопросы, в частности, о необходимости тотальной вакцинации мальчиков и мужчин. Данную вакцинацию некоторые исследователи считают целесообразной для создания коллективного иммунитета и защиты от генитальных кондилом. Не все специалисты разделяют эту точку зрения в связи с её экономическими аспектами. Неясны вопросы о вероятности замещения вакцинных типов вирусами других типов. Обсуждают также необходимость создания
мультивалентной вакцины. Следует ещё раз подчеркнуть, что указанные вакцины — средства профилактики, а не лечения.
ВНЕДРЕНИЕ ОБРАЗОВАТЕЛЬНЫХ ПРОГРАММ СРЕДИ ВРАЧЕЙ И НАСЕЛЕНИЯ
В связи с новыми знаниями о генитальной ПВИ и появлением профилактических вакцин против ВПЧ происходит пересмотр тактики ведения больных. Создание вакцин против ПВИ открывает новые возможности профилактики заболеваний, ассоциированных с данным возбудителем. Вакцины против ВПЧ могут служить отправной точкой при введении в действие разработанной ВОЗ «Глобальной стратегии профилактики и борьбы с инфекциями, передаваемыми половым путём: 2006– 2015 гг.». Программа вакцинации против ВПЧ даёт также возможность усилить профилактические меры против всех ИППП, так как в ходе её реализации подростков убеждают отложить начало половой жизни на более поздний срок или пользоваться презервативами. Вопросы внедрения вакцинации в практику тесно связаны с развитием образовательных программ как среди медицинского персонала, так и среди населения.
СПИСОК ЛИТЕРАТУРЫ
Всемирная Организация Здравоохранения. Подготовка к внедрению вакцин против вируса папилломы человека:
Руководство для стран по разработке политики и программ, 2007. www.who.int/reproductivehealth.
Прилепская В.Н. Профилактика рака шейки матки // Гинекология. — 2007. — № 1. — Т. 9. — С. 12–15.
Dubin G. Enhanced Immunogenicity of a Candidate Human Papillomavirus (HPV) 16/18 L1 Virus Like Particle (VLP) Vaccine with
Novel AS04 adjuvant in Preteens/Adolescents (submitted, 2005) 22.
Harper D.M., Franco E.L., Wheeler C. et al. // Lancet. — 2006. — Vol. 367. — P. 1247–1255.
Roden R. Wu TC. // Expert Rev Vaccines. — 2003. — Vol. 2. — P. 495–516.
Kirnbauer R., Booy F., Cheng N. et al. // Proc. Natl. Acad. Sci. USA. — 1992. — Vol. 89. — P. 12180–12184.
Kirnbauer R., Taub J., Greenstone H. et al. // J. Virol. — 1993. — Vol. 67. — P. 6929–6936.
Stanley M.A. Expert Rev Vaccines. — 2003. — Vol. 2. — P. 381–389.
Jansen K.U., Rosolowsky M., Schultz L.D. et al. // Vaccine. — 1995. — Vol. 13. — P. 1509–1514.
Bryan J.T., Jansen K.U., Lowe R.S. et al. // Med. Virol. — 1997. — Vol. 53. — P. 185–188.
Walboomers J.M., Jacobs M.V., Manos M.M. et al. // J. Pathol. — 1999. — Vol. 189. — P. 12–19.
Herrero R, Castellsagué X, Pawlita M. et al. // J. Natl. Cancer. Inst. — 2003. — Vol. 95. — P. 1772–1783.
World Health Organization. — Geneva, Switzerland: World Health Organization. — 1999. — P. 1–22.
Münger K., Baldwin A., Edwards K.M. et al. // J. Virol. — 2004. — Vol. 78. — P. 11451–11460.
Villa L.L. et al. // British Journ of cancer. — 2006. — Vol. 95. — P. 1459–66. Frazer J.H. et al. // The Pediatric Infectious Dis. J. — Vol. 25. — P. 65–81.
