Синдром поликистозных яичников (СПКЯ) — это патология структуры и функции яичников, характеризующаяся овариальной гиперандрогенией с нарушением менструальной и генеративной функции.
СИНОНИМЫ
Болезнь поликистозных яичников, первичные поликистозные яичники, синдром Штейна–Левенталя, склерополикистозные
яичники.
КОД ПО МКБ-10
E28.2 Синдром поликистоза яичников.
ЭПИДЕМИОЛОГИЯ
Частота данной патологии — примерно 11% среди женщин репродуктивного возраста, в структуре эндокринного бесплодия доходит до 70%, а у женщин с гирсутизмом СПКЯ выявляют в 65–70% наблюдений.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиопатогенез до конца не изучен, несмотря на большое число предложенных теорий. Вместе с тем большинство исследователей считают СПКЯ гетерогенным заболеванием, наследственно обусловленным, характеризующимся нарушением менструального цикла, хронической ановуляцией, гиперандрогенией, увеличением размеров яичников и особенностями их морфологической структуры: двусторонним увеличением размеров яичников в 2–6 раз, гиперплазией стромы и текаклеток, множеством кистозноатрезирующихся фолликулов диаметром 5–8 мм, утолщением капсулы яичников.
Кардинальный признак СПКЯ — овариальная гиперандрогения. Суммируя имеющиеся научные работы по этой проблеме, можно определить следующие механизмы патогенеза. Нарушение гонадотропной функции. Эра синтеза и применения ГнРГ в 80е гг. дала не только возможность индукции овуляции, но и более углублённого изучения роли нарушений гонадотропной функции в патогенезе СПКЯ. Выдвинули гипотезу о первичном нарушении цирхорального ритма выделения ГнРГ с периода пубертата как причины возникновения СПКЯ, возможно, генетически обусловленной. Важную роль отводят средовым (стрессорным) факторам, нарушающим нейроэндокринный контроль в регуляции секреции ГнРГ, в результате чего увеличивается базальный уровень синтеза ЛГ и происходит относительное уменьшение продукции ФСГ. Известно, что период полового созревания критический в жизни девочки, на фоне которого генетические и средовые факторы способствуют манифестации различных нейроэндокринных синдромов. В результате избыточной стимуляции ЛГ повышается продукция андрогенов в текаклетках, формируется кистозная атрезия фолликулов с гиперплазией текаклеток, стромы, не происходит селекции и развития доминантного фолликула. В результате относительного дефицита ФСГ, необходимого для синтеза цитохрома Р450, который активирует ферменты для метаболизма андрогенов в эстрогены, происходит накопление андрогенов и дефицит эстрадиола. По механизмам отрицательной обратной связи уменьшение уровня эстрадиола стимулирует синтез ЛГ, что является вторым фактором для повышения базального уровня ЛГ. Кроме того, эстрогены (в основном эстрон), синтезируемые внегонадно из тестостерона в большом количестве, повышают чувствительность клеток гипофиза к ГнРГ, что способствует хронической гиперсекреции ЛГ. Гиперпродукция андрогенов приводит к атрезии фолликулов, гиперплазии стромы текаклеток и белочной оболочки. Кроме того, повышенные концентрации андрогенов положительно коррелируют с уровнем ингибина В, который подавляет секрецию ФСГ. С другой стороны, увеличение секреции ГнРГ может быть не первичным, а вторичным в ответ на гиперпродукцию андрогенов и уменьшение синтеза эстрадиола в яичниках. При этом овариальная гиперандрогения — это результат нарушения аутопаракринной регуляции роста и созревания фолликулов, а также дисрегуляции цитохрома Р450с17. Вследствие этих нарушений снижается синтез эстрадиола, что по механизму обратной связи стимулирует секрецию ГнРГ. Овариальную гиперандрогению отмечают у пациенток с нормальным уровнем гонадотропинов. При этом показана
гиперреакция текаклеток поликистозных яичников на нормальные уровни ЛГ.
Инсулинорезистентность и гиперинсулинемия. Впервые о сочетании гиперандрогении и инсулинорезистентности при СПКЯ было сообщено в 1980 г., что способствовало развитию гипотезы о том, что ожирение и гиперинсулинемия должны играть основную роль в патогенезе СПКЯ у пациенток с инсулинорезистентностью. Однако гиперинсулинемию отмечают также и у пациенток с нормальной массой тела и СПКЯ. Следовательно, ожирение способствует, но не относится к основным факторам развития инсулинорезистентности при СПКЯ. Частота инсулинорезистентности составляет 35–60%. Патогенетические механизмы инсулинорезистентности до конца не известны, многофакторны и у подавляющего большинства пациенток с СПКЯ обусловлены не дефектом инсулинового рецептора, а нарушениями на рецепторном и пострецепторном уровне трансдукции инсулинового сигнала в клетку. В норме инсулин связывается с трансмембранным инсулиновым рецептором, активируя несколько процессов, в частности аутофосфорилирование тирозина и последовательные реакции транспорта глюкозы в клетку. В результате происходящих каскадных механизмов запускается транспорт глюкозы в клетку, опосредованный инсулином. Важная роль в формировании инсулинорезистентности отводится генетически детерминированному нарушению тирозинкиназного пути фосфорилирования инсулинового рецептора. Серинфосфорилирование рецептора ингибирует активность тирозинкиназы инсулинового рецептора. У пациенток с СПКЯ доказано ингибирование трансдукции инсулинового сигнала в клетку в результате превалирования серинфосфорилирования. Те же механизмы усиливают активность цитохрома Р450с17 — ключевого в синтезе андрогенов как в яичниках, так и в надпочечниках.Определённая роль в периферической инсулинорезистентности принадлежит гиперандрогении, поскольку андрогеныизменяют структуру мышечной ткани в сторону превалирования мышечных волокон II типа, менее чувствительных к инсулину. Сопутствующее ожирение, чаще висцеральное, примерно у 50% пациенток усугубляет имеющиеся нарушения чувствительности к инсулину, оказывая синергичный эффект. В норме не инсулин, а больше инсулиноподобный фактор ростаI играет важную роль в стероидогенезе. Но действие инсулина в концентрации выше нормы реализуется не только через инсулиновые рецепторы, но и рецепторы инсулиноподобного фактора ростаI. Инсулин и инсулиноподобный фактор ростаI способствуют усилению ЛГзависимого синтеза андрогенов в текаклетках и строме, стимулируют избыточную секрецию ЛГ. Инсулин также повышает активность цитохрома Р450с17, таким образом увеличивая продукцию овариальных и адренальных андрогенов. Гиперандрогении также способствует увеличение концентрации свободного биологически активного тестостерона изза уменьшения образования ГСПГ в печени. Показано, что инсулин регулирует продукцию ГСПГ. При гиперинсулинемии синтез ГСПГ снижается, что приводит к повышению концентраций свободных фракций как тестостерона, так и эстрадиола. Кроме того, инсулин подавляет продукцию белков, связывающих инсулиноподобный фактор ростаI, повышая их биологическую активность, а следовательно, синтез андрогенов в яичниках. Роль ожирения сводится к внегонадному синтезу тестостерона и эстрона. Этот процесс имеет автономный характер, не зависит от гонадотропной стимуляции. Эстрон, синтезирующийся в жировой ткани, замыкает «порочный круг» в патогенезе формирования ПКЯ, повышая чувствительность гипофиза к ГнРГ. Овариальные факторы. Последние исследования объясняют гиперпродукцию андрогенов генетически обусловленной дисрегуляцией цитохрома Р450с17 — ключевого фермента в синтезе андрогенов в яичниках и надпочечниках. Активность данного цитохрома регулируют те же механизмы, что участвуют в активации инсулинового рецептора, т.е. имеет место генетическая детерминанта овариальной, надпочечниковой гиперандрогении и инсулинорезистентности.
Показано, что у пациенток с СПКЯ в крови повышена концентрация ингибитора апоптоза, т.е. снижается процесс атрезии фолликулов, которые персистируют. Известно, что примерно у 50% пациенток с СПКЯ отмечают надпочечниковую гиперандрогению. Механизмы повышенной продукции ДГЭАС при нормальной и избыточной массе тела различны. У пациенток с нормальной массой тела (примерно у 30%) имеет место генетически обусловленная дисрегуляции цитохрома Р450с17, что приводит к повышенной продукции адренальных и овариальных андрогенов по единому механизму. У пациенток с ожирением активация андрогенной функции надпочечников обусловлена избыточной продукцией кортиколиберина и, соответственно, АКТГ, поэтому увеличивается синтез не только ДГЭАС, но и кортизола. На основании анализа результатов многочисленных исследований можно предложить два варианта патогенеза СПКЯ у пациенток с нормальной массой тела и у инсулинорезистентных пациенток (рис. 181, 182). На генетические причины надпочечниковой и яичниковой гиперандрогении у пациенток с нормальной массой тела указывают и данные анамнеза и клинической картины, поскольку частота перенесённых заболеваний не выше, чем в популяции, и, кроме как нарушений менструальной и генеративной функции, пациенток ничего не беспокоит. Тогда как у пациенток с ожирением повышена частота ОРВИ и много диэнцефальных симптомов, что указывает на центральный, гипоталамический генез формирования СПКЯ — нарушение нейроэндокринного контроля секреции ГнРГ. Патогенез СПКЯ у инсулинорезистентных больных представляется следующим образом (рис. 18-2). Пубертатный период характеризуется инсулинорезистентностью изза повышенной продукции гормона роста. Инсулин — важный митогенный гормон, необходим в пубертатном периоде в повышенных концентрациях для нормального физического развития и созревания органов и тканей репродуктивной системы. Как уже отмечалось, это критический период в жизни, когда может быть манифестация любой генетически обусловленной патологии, особенно под воздействием различных средовых факторов

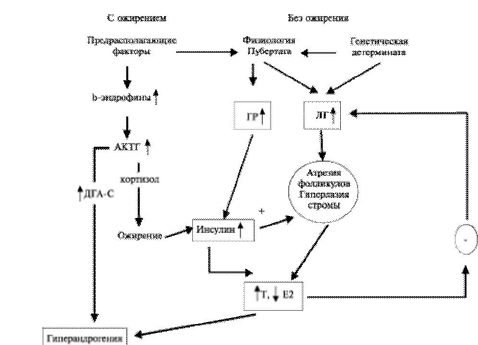
Рис.18-2. Патогенез СПКЯ у инсулинорезистентных больных.
Таким образом, патогенез СПКЯ многофакторный, с вовлечением в патологический процесс овариальных, надпочечниковых и экстраовариальных факторов и имеет различные механизмы у пациенток с нормальной массой тела, ожирением, инсулинорезистентностью.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина характеризуется нарушением менструального цикла, первичным бесплодием, избыточным оволосением, угревой сыпью. В последние годы всё чаще (около 50%) встречаются женщины с нормальной массой тела, слабовыраженными андрогензависимыми дерматопатиями, так называемые безгирсутные пациентки. Менархе своевременный — 12–13 лет. Нарушение менструального цикла с периода менархе — по типу олигоменореи у подавляющего большинства женщин (70%), реже дисфункциональные маточные кровотечения (7–9%). Вторичная аменорея (до 30%) встречается у нелеченых женщин старше 30 лет при сопутствующем ожирении, а у пациенток с нормальной массой тела наблюдается с менархе и не зависит от длительности ановуляции.
ДИАГНОСТИКА
В настоящее время большинство исследователей приняли критерии диагностики, предложенные на Роттердамском консенсусе в 2004 г.: олигоменорея и/или ановуляция, гиперандрогения (клинические и/или биохимические проявления), эхографические признаки поликистозных яичников. Наличие двух из трёх этих признаков диагностирует СПКЯ при исключении других причин формирования ПКЯ.
АНАМНЕЗ
В анамнезе у пациенток с нормальной массой тела частота перенесённых заболеваний не выше, чем в популяции; при ожирении — большая частота перенесённых нейроинфекций, экстрагенитальной патологии, отягощённая наследственность по инсулинонезависимому сахарному диабету, ожирению, артериальной гипертонии.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
При физикальном исследовании морфотип женский, при избыточной массе тела у большинства пациенток висцеральный тип распределения жировой ткани; степень выраженности гирсутизма от скудного до выраженного. Определяют индекс массы тела: избыточной масса тела считается при индексе массы тела более 26 кг/м2, а ожирение — при индексе массы тела свыше 30 кг/м2. В зависимости от характера распределения жировой ткани ожирение может быть по женскому типу, или гиноидное (равномерное распределение жировой ткани), или по мужскому типу (центральное, кушингоидное, андроидное, висцеральное) с преимущественным отложением жировой ткани в области плечевого пояса, передней стенки живота и мезентерии внутренних органов. Висцеральный тип ожирения чаще сопровождается инсулинорезистентностью и наблюдается у 80% пациенток с СПКЯ и избыточной массой тела. Рекомендуют определять не только индекс массы тела, но и отношение объёма талии к объёму бёдер. Этот индекс характеризует тип ожирения и риск возникновения метаболических нарушений. Отношение объёма талии к объёму бёдер более 0,85 соответствует висцеральному типу, а менее 0,85 — женскому типу ожирения. Клиническим проявлением инсулинорезистентности считается наличие «нигроидного акантоза»: участки гиперпигментации кожи в местах трения (паховая, подмышечная области и др.). При пальпации молочных желёз у большинства пациенток определяют признаки фибрознокистозной мастопатии. При гинекологическом исследовании у пациенток с нормальной массой тела определяют увеличенные яичники.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
При исследовании уровня гормонов в крови у большинства пациенток определяют повышенную концентрацию ЛГ, тестостерона, 17-ОП, увеличение соотношения ЛГ/ФСГ более 2,5; в 50–55% наблюдений — снижение концентрации ГСПГ, повышение концентрации ДГЭАС, у 25% пациенток — повышение концентрации пролактина. Чувствительный метод диагностики гиперандрогении — определение индекса свободных андрогенов, который рассчитывается по следующей формуле:
Индекс свободных андрогенов = Общ.Т x 100 / ГСПГ
Значительное повышение уровней 17-ОП и ДГЭАС требует исключения в первую очередь ВГКН. Для этого в современной клинической практике используют пробу с АКТГ. Повышение уровня 17ОП и ДГЭАС (более чем в 8–10 раз) в ответ на введение АКТГ свидетельствует о ВГКН, причиной которой является генетически детерминированный дефицит фермента 21гидроксилазы.
Участие яичников и надпочечников в синтезе тестостерона примерно одинаково — по 30%. Поэтому повышенная концентрация тестостерона не может дифференцировать надпочечниковую и яичниковую гиперандрогению. В связи с чем, практикующим врачам с целью дифференциальной диагностики можно рекомендовать определение в плазме крови ДГЭАС — основного маркёра надпочечниковой гиперандрогении, до и после пробы с дексаметазоном. Исследование 17кортикостероидов и стероидного профиля мочи малоинформативно, поскольку отражает метаболизм всех андрогенов и не может точно выявить их источник даже после проведения пробы с дексаметазоном. Диагностика метаболических нарушений в первую очередь направлена на выявление инсулинорезистентности методом орального глюкозотолерантного теста. При этом в крови определяют базальный и стимулированный приёмом 75 г глюкозы уровень инсулина и глюкозы. Если через 2 ч уровень глюкозы крови приходит к исходным цифрам, а инсулина — нет, это свидетельствует об инсулинорезистентности. Если через 2 ч повышен уровень не только инсулина, но и глюкозы, это свидетельствует о нарушенной толерантности к глюкозе. При этом отмечается повышение базальной концентрации инсулина. На следующем этапе метаболических нарушений развивается инсулинонезависимый сахарный диабет, который диагностируют при повышенной базальной концентрации и глюкозы, и инсулина. При этом проведение глюкозотолерантного теста не рекомендуют. Основные клинические и биохимические критерии инсулинорезистентности: висцеральное ожирение, «нигроидный акантоз», стимулированная глюкозой гиперинсулинемия, уровень инсулина натощак 12,2 мМЕ/л и более, индекс HOMA более 2,5 (инсулин натощак x глюкоза натощак / 22,5). Далее
Таким образом, патогенез СПКЯ многофакторный, с вовлечением в патологический процесс овариальных, надпочечниковых и экстраовариальных факторов и имеет различные механизмы у пациенток с нормальной массой тела, ожирением, инсулинорезистентностью.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина характеризуется нарушением менструального цикла, первичным бесплодием, избыточным оволосением, угревой сыпью. В последние годы всё чаще (около 50%) встречаются женщины с нормальной массой тела, слабовыраженными андрогензависимыми дерматопатиями, так называемые безгирсутные пациентки. Менархе своевременный — 12–13 лет. Нарушение менструального цикла с периода менархе — по типу олигоменореи у подавляющего большинства женщин (70%), реже дисфункциональные маточные кровотечения (7–9%). Вторичная аменорея (до 30%) встречается у нелеченых женщин старше 30 лет при сопутствующем ожирении, а у пациенток с нормальной массой тела наблюдается с менархе и не зависит от длительности ановуляции.
ДИАГНОСТИКА
В настоящее время большинство исследователей приняли критерии диагностики, предложенные на Роттердамском консенсусе в 2004 г.: олигоменорея и/или ановуляция, гиперандрогения (клинические и/или биохимические проявления), эхографические признаки поликистозных яичников. Наличие двух из трёх этих признаков диагностирует СПКЯ при исключении других причин формирования ПКЯ.
АНАМНЕЗ
В анамнезе у пациенток с нормальной массой тела частота перенесённых заболеваний не выше, чем в популяции; при ожирении — большая частота перенесённых нейроинфекций, экстрагенитальной патологии, отягощённая наследственность по инсулинонезависимому сахарному диабету, ожирению, артериальной гипертонии.
ФИЗИКАЛЬНОЕ ИССЛЕДОВАНИЕ
При физикальном исследовании морфотип женский, при избыточной массе тела у большинства пациенток висцеральный тип распределения жировой ткани; степень выраженности гирсутизма от скудного до выраженного. Определяют индекс массы тела: избыточной масса тела считается при индексе массы тела более 26 кг/м2, а ожирение — при индексе массы тела свыше 30 кг/м2. В зависимости от характера распределения жировой ткани ожирение может быть по женскому типу, или гиноидное (равномерное распределение жировой ткани), или по мужскому типу (центральное, кушингоидное, андроидное, висцеральное) с преимущественным отложением жировой ткани в области плечевого пояса, передней стенки живота и мезентерии внутренних органов. Висцеральный тип ожирения чаще сопровождается инсулинорезистентностью и наблюдается у 80% пациенток с СПКЯ и избыточной массой тела. Рекомендуют определять не только индекс массы тела, но и отношение объёма талии к объёму бёдер. Этот индекс характеризует тип ожирения и риск возникновения метаболических нарушений. Отношение объёма талии к объёму бёдер более 0,85 соответствует висцеральному типу, а менее 0,85 — женскому типу ожирения. Клиническим проявлением инсулинорезистентности считается наличие «нигроидного акантоза»: участки гиперпигментации кожи в местах трения (паховая, подмышечная области и др.). При пальпации молочных желёз у большинства пациенток определяют признаки фибрознокистозной мастопатии. При гинекологическом исследовании у пациенток с нормальной массой тела определяют увеличенные яичники.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
При исследовании уровня гормонов в крови у большинства пациенток определяют повышенную концентрацию ЛГ, тестостерона, 17-ОП, увеличение соотношения ЛГ/ФСГ более 2,5; в 50–55% наблюдений — снижение концентрации ГСПГ, повышение концентрации ДГЭАС, у 25% пациенток — повышение концентрации пролактина. Чувствительный метод диагностики гиперандрогении — определение индекса свободных андрогенов, который рассчитывается по следующей формуле:
Индекс свободных андрогенов = Общ.Т x 100 / ГСПГ
Значительное повышение уровней 17-ОП и ДГЭАС требует исключения в первую очередь ВГКН. Для этого в современной клинической практике используют пробу с АКТГ. Повышение уровня 17ОП и ДГЭАС (более чем в 8–10 раз) в ответ на введение АКТГ свидетельствует о ВГКН, причиной которой является генетически детерминированный дефицит фермента 21гидроксилазы.
Участие яичников и надпочечников в синтезе тестостерона примерно одинаково — по 30%. Поэтому повышенная концентрация тестостерона не может дифференцировать надпочечниковую и яичниковую гиперандрогению. В связи с чем, практикующим врачам с целью дифференциальной диагностики можно рекомендовать определение в плазме крови ДГЭАС — основного маркёра надпочечниковой гиперандрогении, до и после пробы с дексаметазоном. Исследование 17кортикостероидов и стероидного профиля мочи малоинформативно, поскольку отражает метаболизм всех андрогенов и не может точно выявить их источник даже после проведения пробы с дексаметазоном. Диагностика метаболических нарушений в первую очередь направлена на выявление инсулинорезистентности методом орального глюкозотолерантного теста. При этом в крови определяют базальный и стимулированный приёмом 75 г глюкозы уровень инсулина и глюкозы. Если через 2 ч уровень глюкозы крови приходит к исходным цифрам, а инсулина — нет, это свидетельствует об инсулинорезистентности. Если через 2 ч повышен уровень не только инсулина, но и глюкозы, это свидетельствует о нарушенной толерантности к глюкозе. При этом отмечается повышение базальной концентрации инсулина. На следующем этапе метаболических нарушений развивается инсулинонезависимый сахарный диабет, который диагностируют при повышенной базальной концентрации и глюкозы, и инсулина. При этом проведение глюкозотолерантного теста не рекомендуют. Основные клинические и биохимические критерии инсулинорезистентности: висцеральное ожирение, «нигроидный акантоз», стимулированная глюкозой гиперинсулинемия, уровень инсулина натощак 12,2 мМЕ/л и более, индекс HOMA более 2,5 (инсулин натощак x глюкоза натощак / 22,5). Далее
