Респираторный дистресс-синдром новорождённых — это заболевание, проявляющееся в виде дыхательной недостаточности в результате развития первичных ателектазов, интерстициального отёка лёгких и гиалиновых мембран, из-за дефицита сурфактанта в условиях дисбаланса кислородного и энергетического гомеостаза.
СИНОНИМЫ
Синдром дыхательных расстройств у новорождённого.
ЭПИДЕМИОЛОГИЯ
РДС — одно из самых частых и тяжёлых заболеваний раннего неонатального периода у недоношенных детей и становится причиной смерти примерно в 25% случаев, а у детей, родившихся на 26–28-й неделе гестации, эта цифра достигает 80%.
КЛАССИФИКАЦИЯ
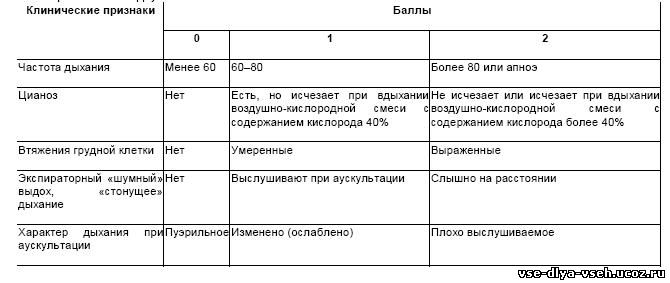
РДС подразделяют по тяжести в соответствии с оценкой в баллах по шкале Доунс (табл. 59-1) на лёгкую форму заболевания (2–3 балла), среднетяжёлую (4–6 баллов) и тяжёлую (более 6 баллов).
Таблица 59-1. Шкала Доунс
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Изза незрелости дыхательной системы существуют особенности бронхолёгочной патологии у недоношенных детей. Верхние дыхательные пути у недоношенных узкие, диафрагма расположена относительно высоко, грудная клетка податлива, ребра расположены перпендикулярно к грудине, а у глубоконедоношенных детей грудина западает. Дыхание бывает поверхностным, ослабленным, его частота составляет 40–54 в минуту, а дыхательный объём по сравнению с доношенными детьми снижен. Ритм дыхания нерегулярный, периодически возникают апноэ. Важной причиной высокой частоты заболеваний бронхолёгочной системы у недоношенных новорождённых служит незрелость сурфактанта лёгких. Сурфактант — мономолекулярный слой на поверхности раздела между альвеолами и воздухом, основная функция которого заключается в снижении поверхностного натяжения альвеол. Сурфактант синтезируют альвеолоциты 2-го типа. Человеческий сурфактант состоит примерно на 90% из липидов и на 5–10% из протеинов. Основная функция сурфактанта (снижение поверхностного натяжения и механическая стабильность во время выдоха альвеол) обусловлена наличием поверхностно-активных фосфолипидов, из которых ведущее место отводят дипальмитоилфофатидилхолину, составляющему 50% от общего количества липидов в сурфактанте. Сурфактант способствует раскрытому состоянию мелких дыхательных путей и служит важным компонентом иммунитета. Он увеличивает фагоцитарную активность макрофагов, подавляет пролиферацию лимфоцитов, уменьшает выделение медиаторов воспаления, обладает бактерицидными и антивирусными свойствами. Первичный дефицит сурфактанта может быть обусловлен низкой активностью ферментов его синтеза, энергетической недостаточностью или усиленной его деградацией. Следует подчеркнуть, что в патогенезе первичной недостаточности сурфактанта и развития РДС могут иметь значение все перечисленные механизмы одновременно. У недоношенных детей с тяжёлым РДС установлена комплексная недостаточность ферментов синтеза, снижение активности таких важнейших ферментов, как лизолецитин трансфераза, лецитинхолестеринацил трансферазы, метилтрансферазы. На продукцию сурфактанта большое влияние оказывают глюкокортикоиды, тиреоидные гормоны, вещества, стимулирующие b-адренорецепторы. Недостаточный синтез и (или) быстрая инактивация сурфактанта, небольшой размер альвеол, податливость грудной клетки, низкая растяжимость лёгких, уменьшение дыхательного объёма и компенсаторное учащение дыхания служат причиной возникновения фетальных ателектазов, которые бывают основной причиной гиповентиляции и неадекватной оксигенацией. Развивающиеся гиперкапния, гипоксия и ацидоз вызывают спазм лёгочных артериол и шунтирование крови через фетальные коммуникации. Снижение лёгочного кровотока приводит к ишемии пневмоцитов и эндотелия сосудов и ещё большему снижению синтеза сурфактанта, что способствует возникновению следующего звена патогенеза — нарушению аэрогематического барьера с последующей транссудацией белков плазмы в просвет альвеол.
КЛИНИЧЕСКАЯ КАРТИНА
Для РДС характерна стадийность развития клинических и рентгенологических симптомов. Через 2–8 ч после рождения появляются постепенное учащение дыхания, раздувание крыльев носа, «дыхание трубача», звучный выдох, ретракция грудины, цианоз, угнетение ЦНС. При неадекватном лечении происходит снижение АД, температуры тела, усиливаются мышечная гипотония, цианоз и бледность кожных покровов, развивается ригидность грудной клетки. При необратимых изменениях в лёгких, возможны отёки, олигурия. При аускультации в лёгких выслушивают ослабленное дыхание и крепитацию. При тяжёлом РДС, как правило, обнаруживают признаки сердечно-сосудистой недостаточности: тахикардию, реже брадикардию, «фиксированный ритм», не изменяющийся при нагрузке (возникает при глубоком нарушении регуляции сердечной деятельности со стороны ЦНС). Возможны расширение границ сердца, цианоз различной степени выраженности, увеличение печени, изменение характера тонов, нередко шумы в сердце. У детей с тяжёлым РДС часто отмечают симптомы левожелудочковой недостаточности, которая может усугубляться дисбалансом между функционированием левого и правого желудочка, что сопровождается усилением застоя в МКК и отёчных изменений в лёгких. Нередко возникает гиповолемия, в патогенезе которой важную роль играет гипоксическое повреждение эндотелия сосудов, приводящее к выходу жидкости из сосудистого русла в ткани. Проявлениями гиповолемии бывают сниженный тургор тканей, холодные конечности, симптом «бледного пятна», снижение АД, тахикардия.
При рентгенологическом исследовании органов грудной клетки отмечают характерную триаду признаков.
·Диффузное снижение прозрачности лёгочных полей.
·Границы сердца нельзя дифференцировать.
·«Воздушная» бронхограмма.
Клиническая картина РДС у недоношенных детей с массой тела менее 1500 г и гестационным возрастом менее 32 нед имеет свои особенности: отмечают более пролонгированное развитие симптомов дыхательной недостаточности исвоеобразную очередность появления симптомов. Самыми ранними признаками заболевания служат разлитой цианоз на багровом фоне кожи и вздутие грудной клетки в передневерхних отделах, позже — втяжение нижних межреберий и
западение грудины. Нарушение ритма дыхания чаще проявляется в виде приступов апноэ. Нередко наблюдают судорожное и парадоксальное дыхание. У детей с экстремально низкой массой тела такие признаки, как раздувание крыльев носа, звучный выдох, дыхание «трубача», выраженная одышка, не отмечают. Несмотря на вздутие грудной клетки, перкуторный звук над лёгкими чаще укорочен. При аускультации лёгких выслушивают резко ослабленное дыхание, а на высоте вдоха с первых часов жизни можно выслушать крепитации. Характерной особенностью РДС у детей с экстремально низкой массой тела бывает высокая частота развития таких осложнений, как интерстициальная эмфизема лёгких, лёгочные кровотечения и функционирующий артериальный проток.
ЛЕЧЕНИЕ
При тяжёлом РДС, как правило, отмечают поражение всех органов и систем, поэтому лечение должно быть комплексным и симптоматическим. Поскольку в основе всех патогенетических механизмов лежит гипоксия и нарушения вентиляции, недоношенные дети с данным заболеванием нуждаются в дополнительной оксигенации и ИВЛ.
Оксигенация
На ранней стадии заболевания даже небольшое повышение концентрации кислорода в воздухе кувеза (до 25–30%) способствует заметному улучшению состояния ребенка (исчезает цианоз, кожа розовеет). Подача кислорода со скоростью 2–3 л/мин бывает достаточной для большинства детей. В более тяжёлых случаях скорость подачи кислорода увеличивают до 4 л/мин, однако содержание кислорода в воздухе кувеза не должно превышать 40%. Следует помнить об опасности токсического воздействия кислорода на сетчатку глаза и развития ретинопатии (которая нередко приводит к слепоте), особенно у глубоко недоношенных детей при их длительном содержании в условиях кувеза с подачей кислорода. Изза этого при улучшении показателей КОС и напряжения кислорода в крови скорость подачи кислорода следует уменьшить. Для проведения терапии кислородом при самостоятельном дыхании ребенка используют кислородные шланги, кислородную маску, кислородную палатку, кислородные носовые катетеры («усы»), подачу кислорода с созданием постоянного положительного давления в конце выдоха. В настоящее время одним из самых эффективных способов создания постоянного положительного давления в конце выдоха служит методика постоянного положительного давления с вариабельным потоком. Устройство, создающее вариабельный поток в зависимости от потребности пациентки, позволяет более эффективно, чем другие способы создания постоянного положительного давления, увеличивать функциональную остаточную ёмкость лёгких и поддерживать стабильное давление в дыхательных путях, облегчая новорождённому как вдох, так и выдох. В связи с тем что травматизация альвеол у недоношенных новорождённых может начинаться практически с первым вдохом, наиболее актуальным подходом к профилактике и лечению РДС у них в настоящее время служит создание постоянного положительного давления через назальные канюли в родильном блоке сразу после рождения. По данным ряда исследователей, подобная тактика позволяет снизить частоту проведения ИВЛ у недоношенных.
Искусственная вентиляция легких
При прогрессировании дыхательной недостаточности проводят ИВЛ. Показания к ИВЛ перечислены ниже.
·Повторные эпизоды апноэ с брадикардией.
·Потребность в воздушно-кислородной смеси с содержанием кислорода более 60% при постоянном положительном давлении в конце выдоха.
·Оценка по шкале Доунс более 6 баллов.
·Стойкая длительная брадикардия.
·При дыхании воздушно-кислородной смесью с содержанием кислорода 60% РаСО2 >60 мм рт.ст. и РаО2 <60 мм рт.ст. Поскольку в практической деятельности мониторинг газового состава артериальной крови проводят редко, чаще для определения показаний используют оценку выраженности дыхательных нарушений по шкале Доунс. Оценку следует выставлять в первые сутки жизни всем новорождённым каждые 3 ч, а при наличии дыхательных нарушений — в течение всего времени, пока эти нарушения сохраняются. Кратковременную ИВЛ можно проводить через кислородную маску, однако для недоношенных ИВЛ, как правило, бывает пролонгированной и её осуществляют через эндотрахеальную трубку.
Сурфактантзамещающая терапия
Концепция о том, что в основе РДС у новорождённых бывает структурно-функ-циональная незрелость системы сурфактанта, в настоящее время остается ведущей. Однако первые попытки использования сурфактанта с лечебной целью были неэффективны. В 1980 г. T. Fujiwara опубликовал первые результаты успешного применения в клинических условиях однократной эндотрахеальной дозы полусинтетического сурфактанта, выделенного из лёгких теленка. Широко использовать препараты сурфактанта в клинической практике стали с 1989 г. Использование сурфактанта у недоношенных новорождённых (средняя доза сурфактанта составляет 100 мг фосфолипидов на кг массы тела) — один из наиболее широко изученных видов терапии в неонатологии. Более 35 рандомизированных исследований было сделано только с 1985 по 1992 г., причём смертность от любых причин на фоне применения сурфактанта снизилась на 30–40%. Было отмечено улучшение газообмена в лёгких, снижение частоты баротравмы. В настоящее время обсуждают 2 метода использования сурфактанта. Сурфактант назначают новорождённым с профилактической целью в течение 20–30 мин после рождения. Данный подход считают наиболее эффективным. Лекарственное средство назначают с лечебной целью у новорождённых в возрасте 2–24 ч после того, как диагностирован РДС и определены параметры ИВЛ (чем раньше, тем лучше).
Выделяют следующие препараты сурфактанта.
·Естественный сурфактант, выделенный из человеческой АЖ, полученной во время операции КС при доношенной беременности.
·Естественный препарат из лёгких телят и поросят.
·Смеси сурфактанта из лёгких теленка с синтетическим фосфолипидом колфосцерила пальмитатом.
·Полностью синтетические сурфактантные препараты, содержащие смесь фосфолипидов, дисперсных и эмульгизирующих веществ.
Главное отличие синтетических сурфактантов заключается в том, что они не содержат апопротеинов, входящих в состав естественного сурфактанта. Человеческий сурфактант отличается от сурфактантов животного происхождения тем, что содержит не только низкомолекулярные гидрофобные апопротеины SP-B и SP-C, но и крупномолекулярный гидрофильный апопротеин SP-А. Непосредственный эффект после введения различных сурфактантзамещающих препаратов новорождённым с РДС, заключающийся в увеличении напряжения кислорода в крови и возможности изменения параметров ИВЛ, наступает быстрее и сильнее при использовании естественных сурфактантов. Однако конечные результаты лечения, о которых судят по уровню летальности от РДС, частоте баротравмы лёгких, выживаемости детей с бронхолёгочной дисплазией, не отличаются в группах детей, получавших естественные и искусственные сурфактанты. В сравнительных испытаниях было показано более быстрое снижение параметров ИВЛ, меньшее количество пневмотораксов и летальных исходов при применении естественного сурфактанта. Естественный сурфактант может приводить к увеличению частоты внутрижелудочковых кровотечений, но частота серьёзных кровоизлияний (3-й и 4-й степени) не увеличивается. В настоящее время предпочтение отдают препаратам естественного сурфактанта.
У новорождённых с РДС, введение многократных доз естественного сурфактанта способствует улучшению показателей оксигенации и вентиляции, уменьшению риска пневмоторакса и повышению выживаемости. Многократное введение сурфактанта новорождённым с дыхательной недостаточностью приводит к улучшению клинического результата лечения.
При использовании сурфактантзамещающих препаратов необходимо соблюдать определённые условия.
·Все препараты сурфактанта вводят только эндотрахеально детям, находящимся на ИВЛ.
·Их использование возможно только в условиях реанимационного отделения, а при раннем введении в родильном блоке.
·В случаях использования специального адаптера, перед введением необходимо проверить правильность расположения адаптера в эндотрахеальной трубке.
·После введения препарата возможно быстрое повышение напряжения кислорода и снижение напряжения углекислого газа, а также изменение КОС крови, поэтому необходим регулярный контроль этих показателей.
·Следует своевременно изменять параметры ИВЛ в соответствии со степенью оксигенации крови из-за риска развития гипероксии.
·Перед использованием препаратов необходимо провести коррекцию метаболического ацидоза, который отрицательно влияет на эффективность действия сурфактанта (в случае лечебного введения сурфактанта).
·В первые минуты после микроструйного введения сурфактанта, до его распределения в лёгких возможны крупнопузырчатые хрипы на вдохе, поэтому в течение первых 4–6 ч после использования препарата следует
воздерживаться от отсасывания содержимого из трахеи и бронхов.
·При проведении высокочастотной ИВЛ (частота дыхания более 60 в минуту, время выдоха менее 0,45 с) рекомендовано следить за тем, чтобы время выдоха после введения препарата было достаточно продолжительным.
Способы введения препаратов сурфактанта приведены ниже.
·При струйном введении препарат вводят с помощью шприца непосредственно в эндотрахеальную трубку через зонд, помещённый в неё или через боковое отверстие коннектора в виде 1–4 инстилляций, с перерывом 30–60 с с изменением положения (позы) ребенка, поворачивая его на правый и левый бок, если позволяет состояние, после каждой инстилляции (для более равномерного распределения препарата в лёгких). После каждой инстилляции
обязательно проведение ИВЛ (ручной или аппаратной).
·Капельное введение осуществляют без отключения ребенка от аппарата ИВЛ с использованием шприцевого насоса или перфузора, которые присоединяют к боковому отверстию специального коннектора. Скорость введения
сурфактанта при капельном введении составляет 16 мл/ч.
·В виде аэрозолей препараты сурфактанта рекомендуют вводить с помощью альвеолярного небулайзера, включенного в контур дыхательного аппарата, максимально близко к эндотрахеальной трубке для уменьшения потерь препарата. При использовании аэрозолей желательно применять аппараты ИВЛ, позволяющие подавать аэрозоли синхронно с вдохом. Аэрозоль препарата нельзя создавать с помощью ультразвукового прибора (небулайзера или ингалятора), поскольку сурфактант разрушается при обработке эмульсии ультразвуком. При введении сурфактанта достаточно быстро наблюдают клинический эффект: увеличение ФОЕ c последующим повышением кровотока в регионах лёгких с увеличенной вентиляцией, повышение оксигенации, снижение лёгочного сосудистого сопротивлении. Повторно вводить сурфактант рекомендуют в случаях, когда в течение 6–12 ч после лечения состояние ребенка ухудшается и отмечают потребность в повышении концентрации кислорода (>30%).
Читайте также Асфиксия новорождённого
