КОД ПО МКБ-10
С50 Злокачественное заболевание молочной железы.
С50.0 Сосок и ареола.
С50.1 Центральная часть молочной железы.
С50.2 Верхневнутренний квадрант.
С50.3 Нижневнутренний квадрант.
С50.4 Верхненаружный квадрант.
С50.5 Нижненаружный квадрант.
С50.6 Подмышечная область.
С50.8 Распространение более чем на одну из вышеуказанных зон.
С50.9 Локализация неуточнённая.
D05.0 Дольковая карцинома in situ.
D05.1 Внутрипротоковая карцинома in situ.
ЭПИДЕМИОЛОГИЯ
Рак молочной железы — самое распространённое онкологическое заболевание у женщин. Заболеваемость раком молочной железы неуклонно растёт и ежегодно в мире выявляют не менее 1 млн вновь заболевших. В США на протяжении жизни раком молочной железы заболевает каждая восьмая женщина. Прогнозируемый рост числа заболевших к 2010 году — 1,5 млн. Заболеваемость раком молочной железы в странах Европейского союза составляет 95–105, а смертность 30–40 случаев на 100 тыс. женщин в год. В общей структуре заболеваемости женского населения новообразования молочных желёз составляют 30%. В 2002 г. в России было диагностировано 45857 больных раком молочной железы, составивших 19,3% общей заболеваемости женщин злокачественными новообразованиями. Максимальные показатели заболеваемости зарегистрированы в Москве — 49,4 и в Санкт–Петербурге — 48,6 на 100 тыс. женского населения. В 2002 г. 22,1 тыс. женщин в России умерли от рака молочной железы. Смертность от рака молочной железы в 2002 г. составила 16,7%. Этотретья по значимости причина смерти женского населения после болезней системы кровообращения и несчастных
случаев.
ПРОФИЛАКТИКА
Профилактика рака молочной железы не разработана. Известен защитный эффект родов — риск заболеть раком молочной железы в 2–3 раза выше у женщин, впервые родивших в возрасте старше 30 лет, по сравнению с женщинами, родившими до 20 лет. В некоторых случаях выполняется двусторонняя мастэктомия и овариоэктомия при генетически доказанном наследственном раке молочной железы, что снижает риск рака молочной железы у носительниц мутаций BRCA I и II на 89,5–95%.
СКРИНИНГ
Скрининг — первый отборочный этап профилактического обследования практически здорового населения с целью выявления лиц, имеющих скрыто протекающее заболевание. Основные методы скрининга: маммография, обследование молочных желёз врачом и самообследование. Около 90% опухолей молочных желёз женщины выявляют самостоятельно. При этом не менее чем у половины из них процесс первично неоперабелен. Маммография — ведущий метод скрининга рака молочной железы у женщин старше 40 лет, поскольку специфичность метода составляет не менее 95%. Проведение скрининга особенно актуально в России, где до 40% первичных больных раком молочной железы выявляются с III–IV стадией заболевания. В развитых странах маммографический скрининг снижает смертность от рака молочной железы на 20%. Периодичность проведения маммографии после 40 лет составляет один раз в 2 года, после 50 — один раз в год.
КЛАССИФИКАЦИЯ
Гистологические формы рака молочной железы:
●неинфильтрирующие опухоли:
♦внутрипротоковый рак;
♦дольковый рак;
●инфильтративный рак:
♦инфильтративный протоковый рак;
♦инфильтративный дольковый рак;
●редкие гистологические формы:
♦слизистый;
♦медуллярный;
♦папиллярный;
♦тубулярный;
♦аденокистозный;
♦секреторный;
♦апокриновый;
♦рак с метаплазией;
♦другие.
●рак Педжета (соска).
Около 85–90% инвазивных карцином происходит из эпителия протоков.
Международная клиническая классификация TNM (2002 г.)
Первичная опухоль:
●Tis — рак in situ;
●T1 — размер опухоли до 2,0 см;
●T1mic — размер опухоли до 0,1 см.
●T1a — размер опухоли до 0,5 см;
●T1b — размер опухоли до 1,0 см;
●T1c — размер опухоли от 1,0 до 2,0 см;
●T2 — размер опухоли от 2,0 до 5,0 см;
●T3 — размер опухоли более 5,0 см;
●T4 — распространение опухоли на грудную стенку, кожу;
●T4a — распространение опухоли на грудную стенку;
●T4b — отёк кожи, изъязвление, сателлиты в коже;
●T4c — признаки 4а, 4b;
●T4d — «воспалительная» карцинома.
Поражение регионарных лимфатических узлов:
●Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов.
●N0 — нет признаков поражения лимфоузлов.
●N1 — смещаемые подмышечные лимфатические узлы на стороне поражения.
●N2а — фиксированные друг с другом подмышечные лимфатические узлы.
●N2b — клинически определяемые метастазы в парастернальные лимфатические узлы при отсутствии клинически
определяемых метастазов в подмышечных лимфатических узлах.
●N3а — метастазы в подключичные лимфатические узлы с или без метастазов в подмышечных лимфатических узлах.
●N3b — метастазы в парастернальные лимфатические узлы при наличии метастазов в подмышечные лимфатические
узлы.
●N3c — метастазы в надключичные лимфатические узлы на стороне поражения с или без метастазов в подмышечных или
парастернальных лимфатических узлах.
Отдалённые метастазы:
●М0 — нет клинически определяемых отдалённых метастазов;
●М1 — клинически определяемые отдалённые метастазы.
Стадии:
●стадия 0: TisN0M0;
●стадия I: T1N0M0;
●стадия IIA: T1–2N0M0;
●стадия IIB: T2N1M0, T3N0M0;
●стадия IIIA: T0–2N2M0, T3N1–2M0;
●стадия IIIB: T4N0–2M0;
●стадия IIIC: T1–4N3M0;
●стадия IV: наличие M1.
ЭТИОЛОГИЯ
Этиология заболевания не известна, специфический этиологический фактор не выявлен. Отмечают роль в развитии рака молочной железы особенностей образа жизни и факторов окружающей среды. Однако лишь 30–50% случаев рака молочной железы можно объяснить наличием известных факторов риска.
Выделяют следующие группы по степени риска развития рака молочной железы:
●низкого риска (риск выше, чем в популяции, в 1–2 раза):
♦использование КОК в раннем возрасте, особенно до первых родов;
♦ЗГТ повышает риск возникновения рака молочной железы на 35%;
♦диета, богатая жирами, особенно насыщенными, поскольку в этом случае выше уровень свободного эстродиола в плазме крови;
♦прерывание первой беременности;
●среднего риска (риск выше, чем в популяции, в 2–3 раза):
♦раннее менерхе;
♦поздняя менопауза;
♦первые роды после 30 лет;
♦бесплодие;
♦наличие рака яичников, эндометрия или толстой кишки в анамнезе;
♦употребление алкоголя;
♦увеличение риска возникновения рака молочной железы происходит при значении индекса массы тела выше 30 кг/м2;
♦пролиферативные заболевания молочных желёз;
♦ожирение в постменопаузе;
●высокого риска (риск выше, чем в популяции, в 4 и более раз):
♦возраст более 50 лет;
♦отягощённый семейный анамнез по развитию рака молочной железы у родственников 1й линии;
♦рак молочной железы по данным анамнеза;
♦воздействие ионизирующей радиации по данным анамнеза;
♦пролиферативные заболевания молочных желёз с атипией эпителия;
♦мутации генов BRCA1, BRCA2.
Критериями для установления генетического диагноза наследственного рака молочной железы служат наличие в семье одной и более родственниц 1–2й степени родства, страдающих раком молочной железы, ранний возраст манифестации заболевания, двустороннее поражение молочных желёз, первичная множественность новообразований у пробанда (и (или) его родственников), специфические опухолевые ассоциации. На настоящий момент идентифицировано не менее 4 генов, отвечающих за предрасположенность к раку молочной железы (р53, BRCA1, BRCA2, PTEN). Среди них р53 и PTEN ответственны за развитие специфической индивидуальной и семейной предрасположенности к синдромам Ли–Фраумени и Кауден. Исследования показали, что мутации BRCA1 и BRCA2 (breast cancer associated) ответственны за 40–70% случаев развития наследственного рака молочной железы. При этом выяснили, что у носителей мутаций данных генов риск первичного рака молочной железы достигает 80%, а риск развития рака второй молочной железы — 50–60% (в общей популяции 2 и 4,8% соответственно). Пик заболеваемости раком молочной железы у носителей BRCA1 соответствует возрасту 35–39 лет, у носителей BRCA2 — возрасту 43–54 лет. Прогноз у носителей мутации BRCA2 более благоприятный, чем у носителей мутации BRCA1 и при спорадическом раке молочной железы. У носителей мутаций BRCA1 и BRCA2 ранние роды не оказывают защитного действия. Рожавшие носители мутаций этих генов существенно чаще (в 1,71 раза) заболевают раком молочной железы до 40 лет, чем не рожавшие. Каждая последующая беременность увеличивает эту вероятность.
Лечебная тактика у носителей мутаций этих генов должна быть пересмотрена. В случае таких пациенток следует:
●рекомендовать проведение профилактической мастэктомии;
●отказаться от органсохраняющих операций;
●рекомендовать профилактическое удаление другой молочной железы;
●расширить показания к химиотерапии;
●рекомендовать профилактическую оварэктомию (при мутации BRCA1).
В настоящий момент общие сведения о раке молочной железы представлены постулатами B. Fisher:
●опухолевая диссеминация хаотична (нет обязательного порядка рассеивания опухолевых клеток);
●опухолевые клетки попадают в регионарные лимфатические узлы путём эмболизации и этот барьер не эффективен;
●распространение опухолевых клеток по току крови имеет важнейшее значение для опухолевой диссеминации;
●операбельный рак молочной железы — системное заболевание;
●маловероятно, что варианты оперативного вмешательства существенно влияют на выживаемость;
●75% больных с поражением регионарных лимфатических узлов и 25% больных с непоражёнными лимфатическими узлами через 10 лет умирают от отдалённых метастазов;
●потребность в дополнительных, системных лечебных воздействиях при раке молочной железы очевидна.
На сегодняшний день при выборе тактики лечения рака молочной железы учитывают следующие биологические факторы прогноза:
●размер опухолевого узла;
●наличие метастазов в регионарных лимфатических узлах;
●степень злокачественности согласно гистологическому исследованию;
●рецепторный статус опухоли (ЭР, ПР): наличие ЭР и (или) ПР в опухолевых клетках можно рассматривать как биохимический признак высокой степени дифференцировки. Индивидуальная чувствительность клеток рака молочной железы к гормонотерапии, а следовательно, и эффективность последней в значительной степени зависит от экспрессии на клеточной мембране ЭР и ПР. Содержание ЭР и ПР в разных возрастных группах (пре и постменопаузной) различно: у 45% больных в пременопаузе и 63% больных в постменопаузе опухолевые клетки содержат ЭР и ПР. Роль всех известных методов гормонотерапии сводится, в конечном счёте, к уменьшению влияния эстрогенов на клетки опухоли, что в случае гормонзависимого рака молочной железы приводит к замедлению роста новообразования;
●показатели активности синтеза дезоксирибонуклеиновой кислоты (ДНК) — количество ДНК анэуплоидных опухолей; доля клеток, находящихся в Sфазе клеточного цикла; гиперэкспрессия Ki67, плоидность, активность тимидинкиназы и др.:
Ki67 — опухолевый маркёр, характеризующий пролиферативную активность опухоли. Данный ядерный Аг экспрессируется во всех фазах клеточного цикла (G1, S, G2, M) кроме G0, что делает его маркёром роста клеточной популяции;
●рецепторы факторов или регуляторов роста (рецепторы эпидермального фактора роста — EGFR; HER2/neu): HER2/neu — трансмембранный гликопротеин (продукт гена cerbB2/neu), представляющий собой тирозинкиназный рецептор. Стимуляция данного рецептора приводит к запуску транскрипционных механизмов, что ускоряет пролиферацию и рост клеток. На примере экспериментальных моделей было показано, что Her2/neu может обусловливать резистентность опухоли к химио и эндокринотерапии. VEGF — сосудистый эндотелиальный фактор роста, индуцирует пролиферацию и миграцию эндотелиальных клеток, в то же время ингибируя их апоптоз (опухолевую прогрессию и метастазирование считают процессами, зависимыми от ангиогенеза). Тимидинфосфорилаза по структуре и функциям идентична эндотелиальному фактору роста, выделяемому тромбоцитами (PDECGF), и является ферментом, катализирующим обратное дефосфорилирование тимидина в тимин и 2дезоксирибозо1фосфат. Гиперэкспрессия тимидинфосфорилазы ускоряет рост опухоли, а также обеспечивает клеткам резистентность к апоптозу, индуцированному гипопсией;
●онкогены BRCA1, BRCA2.
Идут исследования новых биологических факторов: Bcl2, p53, PTEN, CDH1, MS H2, ML H1, ALCAM/CD166.
Семейство белков Bcl2 достаточно неоднородно. Некоторые его представители (Bcl2, BclXI) тормозят апоптоз (гибель клетки), ингибируя высвобождение из митохондрий цитохромаС и апоптозиндуцирующего фактора (регулируется при участии р53), в то время как другие (Bax, Bad), наоборот, считают активаторами апоптоза. р53 — ядерный белок, который при повреждении ДНК запускает механизм апоптоза, что позволяет избежать размножения клеток с изменённым генетическим аппаратом. Нормальный p53 быстро деградирует, и его присутствие в ядре практически неопределимо. Появление мутантного р53 блокирует апоптоз, что предопределяет резистентность клетки к химио и лучевой терапии.
ПАТОГЕНЕЗ
Этапы развития новообразований до конца не изучены. Процесс канцерогенеза включает этап инициации, промоции и прогрессии. Процесс канцерогенеза инициирует мутация протоонкогенов, превращающихся в онкогены и стимулирующих рост клеток (повышающих продукцию мутагенных факторов роста либо воздействующих на поверхностные рецепторы клеток — например HER2/neu). После повреждения клетки эстрогены стимулируют репликацию повреждённой клетки до того, как эти повреждения будут восстановлены. Присутствие эстрогенов — обязательный фактор развития рака молочной железы, обеспечивающий этап промоции. Отдалённые метастазы возникают задолго до клинического проявления опухолевого процесса — в течение первых 20 удвоений, с началом ангиогенеза в опухоли.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина достаточно разнообразна и зависит от распространённости процесса: от полного ее отсутствия (при непальпируемых опухолях) до классической картины рака молочной железы (см. Физикальное исследование).
ДИАГНОСТИКА
АНАМНЕЗ
При сборе анамнеза необходимо обратить внимание на сроки появления первых симптомов заболевания, последовательность развития опухолевого процесса (динамику роста опухоли, изменений кожных покровов, соска и ареолы, появления увеличенных лимфатических узлов в подмышечной области, выделений из соска); выполнялись ли операции на молочных железах, их травмы; проводилось ли лечение заболеваний лёгких, костной системы, печени за последние 6–8 мес (типичная локализация отдалённых метастазов при раке молочной железы).
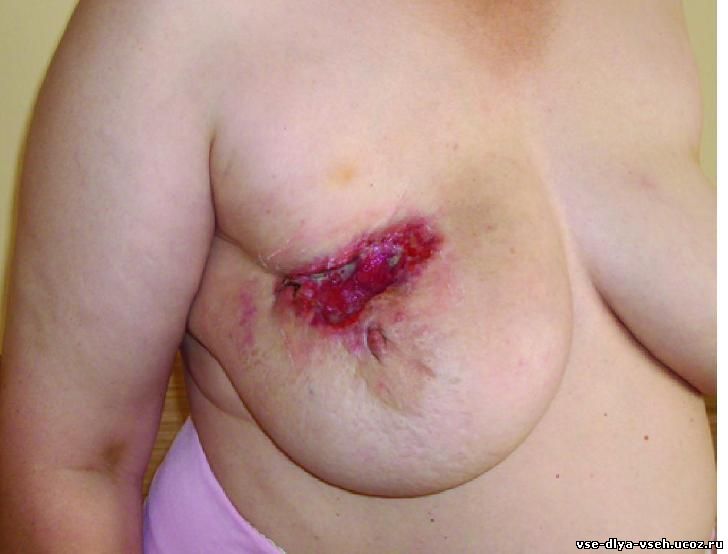
ФИЗИКАЛЬНОЕ ИССЛЕДОЕВАНИЕ
Осмотр и пальпация играют большую роль в диагностике рака молочной железы (рис. 30-3). Следует обратить внимание на нарушение формы молочных желёз (деформация), состояние соска и ареолы (втяжение, изъязвление), состояние кожных покровов (гиперемия, отёк, наличие внутрикожных метастазов). Из кожных симптомов чаще всего наблюдают симптом «лимонной корки» (лимфатический отёк сосочкового слоя дермы), симптом «площадки» (ригидность кожи над опухолью), симптом «умбиликации» (втяжение кожи, обусловленное инфильтрацией связок Купера).