Оценка противоопухолевого действия химиотерапии
Комитетом экспертов ВОЗ разработаны единые критерии оценки объективного эффекта лекарственного лечения злокачественных опухолей:
1) полная регрессия или ремиссия заболевания — это исчезновение всех проявлений опухолевого процесса;
2) частичная регрессия или ремиссия — это уменьшение всех или отдельных опухолевых очагов на 50% и более при отсутствии прогрессирования других очагов поражения;
3) стабилизация — это уменьшение имеющихся опухолевых очагов менее чем на 50% при отсутствии новых поражений или увеличение не более чем на 25%;
4) прогрессирование заболевания — это появление новых очагов опухолевого поражения или увеличение размеров старых очагов на 25% и более.
Для определения того или иного варианта объективного эффекта необходимой минимальной продолжительностью лечебного действия цитостатиков считают 4 недели.
При гемобластозах критерием определения эффективности лечения считается нормализация картины периферической крови и костного мозга.
Продолжительность полной или частичной регрессии (ремиссии) определяют в виде промежутка времени от момента установления до даты прогрессирования болезни. При оценке степени объективного эффекта кроме изменения размеров первичного опухолевого очага и метастазов также учитывают динамику биохимических и других лабораторных показателей (например, иммунологических маркеров опухоли). Своевременная объективная оценка противоопухолевого действия цитостатиков позволяет изменить программу лечения или прекратить химиотерапию при неэффективности последней.
Субъективный эффект лекарственного лечения онкологических больных оценивают по изменению общесоматического статуса (шкала Карновского), изменению степени болевого синдрома и массы тела.
Для характеристики степени выраженности болевого синдрома,аппетита и функции внутренних органов рекомендована следующая шкала: 0 — нет симптомов, 1 — умеренные симптомы, 2 — средней выраженности, 3 — тяжелые, 4 — особенно тяжелые, угрожающие жизни.
В случаях паллиативного лечения распространенных форм злокачественных новообразований лекарственная терапия является инструментом повышения качества жизни онкологических больных. В настоящее время исследование качества жизни широко используется в клинической медицине, в том числе и в онкологии. Качество жизни — это совокупность параметров, отражающих изменение течения жизни с оценкой физического состояния, психологического благополучия, социальных отношений и функциональных способностей в период развития заболевания и его лечения. Качество жизни рассматриваетсякак динамический показатель, меняющийся во времени и зависящий от клинической динамики заболевания, процесса лечения и системы оказания медицинской помощи. Появлению понятия «качество жизни» исторически способствовало определение здоровья, принятое ВОЗ в 1947 г., оценка статуса больного по шкале Карновского (1949) и президентская оценка здоровья, принятая в США в 1960 г. Многофункциональная оценка качества жизни включает разные сферы деятельности: функциональную, физиологическую, психологическую, социальную, духовную, сексуальную. Качество жизни онкологических больных должно оцениваться как минимум по трем параметрам: сравнение с нормой, максимальная токсичность, максимальный терапевтический эффект, и по нескольким направлениям с учетом временных факторов: когда наступает ухудшение или улучшение, как долго оно сохраняется; какие условия необходимы для поддержания улучшения; преимущества новых клинических условий в сравнении с бывшими ранее.
Для оценки качества жизни больных создано большое количество специальных опросников. Стандартными опросниками в онкологической практике являются: FAGT (Functional Assessment of Cancer Therapy — функциональная оценка противоопухолевой терапии); EORTC QLQ-C30 (опросник Европейской организации исследований и лечения рака, содержащий 30 вопросов, 5 параметров и параметры общего качества жизни), CARES-SF (система оценки после раковой реабилитации, включающая 59 вопросов, 5 параметров и оценку общего качества жизни) и др. Больные, получающие паллиативное лечение с целью контроля и улучшения качества жизни, нуждаются в качественно иной медицинской помощи и психологической поддержке.
Широкое использование противоопухолевых препаратов в клинической практике продемонстрировало тот факт, что метод химиотерапии способен значительно изменить естественное биологическое течение многих злокачественных опухолей. Большинство онкологических больных после реабилитационных мероприятий возвращается к нормальной жизнедеятельности, поэтому категории оценки эффективности лекарственного лечения дополнены такими понятиями, как сроки до прогрессирования, продолжительность ремиссий, проценты выживших с признаками заболевания и без них в течение 1 года, 2 лет, 3 лет и 5 лет, симптоматический эффект, медиана продолжительности жизни. Противоопухолевая химиотерапия может сопровождаться широким спектром разнообразных осложнений различной степени тяжести, проявление которых связано с недостаточной избирательностью противоопухолевого действия цитостатиков.
Для правильного выбора химиопрепарата в клинической практике решающее значение имеют представления о противоопухолевом спектре его действия, механизме цитотоксического действия, побочных токсических эффектах препарата. При планировании любого вида химиотерапии нужно учитывать специфические особенности гистогенеза опухолей, исходящих из различных тканей. Большинство цитостатиков оказывает ингибирующее действие на небольшую группу опухолей, а некоторые препараты имеют исключительно узконаправленное действие только на один вид новообразований (например, стрептозотоцин при инсуломах; хлодитан при опухолях коры надпочечников). Таким образом, степень органотропности химиопрепаратов обусловливает главный принцип рациональной химиотерапии — адекватный выбор химиопрепарата в соответствии с определенным видом опухоли. Однако при некоторых злокачественных новообразованиях, отличающихся многообразием морфологических вариантов (например, рак легкого) или неоднородностью строения (смешанные опухоли яичка), оптимальный выбор лекарственной терапии невозможен без учета этих факторов.
Многолетний опыт использования комбинированной химиотерапии показывает, что положительный эффект лекарственного лечения может быть достигнут только при соблюдении некоторых принципов и правил противоопухолевой терапии. Важнейшим принципом химиотерапии является соотношение между величиной дозы химиопрепарата и эффектом лечения. Особенность всех цитостатиков состоит в том, что они имеют узкий интервал терапевтического действия, так как доза, предназначенная для противоопухолевого эффекта, распределяется неравномерно и частично расходуется на токсическое повреждение нормальных, активно пролиферирующих тканей. Между дозой химиопрепарата и терапевтическим эффектом существует прямо пропорциональная зависимость. Для каждого цитостатика определена максимально допустимая разовая доза, превышение которой грозит различными токсическими реакциями. Обычно дозу рассчитывают в каждом индивидуальном случае по специальной номограмме на единицу поверхности тела. В экспериментальной химиотерапии было показано, что при небольшом снижении дозы цитостатика возможен полный регресс опухоли, но в этом случае не все опухолевые клетки уничтожаются и рецидив заболевания предопределен. По данным Миланского онкологического института (1993), уменьшение дозы химиопрепарата на 20% сопровождается снижением выраженности лечебного эффекта на 50%. Вопрос о дозах цитостатиков, временных интервалах между введением отдельных препаратов в комбинациях и повторениями курсов химиотерапии одновременно связан с цитокинетикой опухолевого роста и состоянием активно пролиферирующих нормальных тканей, особенно кроветворной системы, которая в первую очередь подвергается токсическому действию химиопрепаратов.
В связи с ограниченной толерантностью нормальных тканей к химиопрепаратам максимальный эффект (т.е. уничтожение всех опухолевых клеток) может быть достигнут только путем многократного повторного применения стандартной лечебной дозы. Считается, что максимальное число опухолевых клеток погибает тогда, когда разовая доза каждого цитостатика по возможности максимальна, а интервал между курсами химиотерапии достаточен, чтобы не допустить возобновления роста опухоли.
Соблюдение принципов проведения интермиттирующего лечения в виде циклов с интервалами, свободными от лечения, также необходимо в связи с периодом восстановления нормальных тканей (костный мозг) от токсического повреждения.
Цитогенетические исследования костного мозга в сопоставлении с изменениями в периферической крови — лейкопенией и (или) тромбоцитопенией — показывают, что восстановление наступает к 21-му дню и завершается полностью к 28-му дню. Именно эти сроки (считая от первого дня предыдущего цикла) используются на практике в качестве оптимальных для повторения курсов химиотерапии. Интервалы могут продлеваться в случаях стойкой лейкопении или других сохраняющихся токсических эффектах лечения.
Кроме того, на эффективность лечения могут влиять факторы повышенного риска, усиливающие побочные эффекты химиотерапии. К ним относят пожилой возраст (старше 60 лет), состояние иммунитета, объем предшествовавшего лечения, общий соматический статус больных (ниже 50% по шкале Карновского), гипопротеинемию, гепатопатию с явлениями холестаза, наличие серозных выпотов в полостях. Пожилой возраст больных характеризуется снижением резервов костного мозга и, кроме того, снижением клубочковой фильтрации в почках до 40%, что может способствовать увеличению миело-токсичности во время химиотерапии. Фактор выраженного нарушения питания или очаг хронической инфекции также будут способствовать увеличению числа общих осложнений.
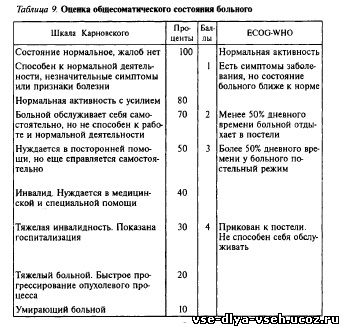
Правильная оценка общего соматического состояния больного является залогом адекватного лечения. Критерии оценки представлены в виде шкалы Карновского (1948) и адаптированы к шкале ECOG-WHO (табл. 9).
Таблица 9. О ц е н к а о б щ е с о м а т и ч е с к о г о с о с т о я н и я б о л ь н о г о
Клиническая классификация побочных эффектов химиотерапии злокачественных опухолей (M.J1. Гершанович, 1982)
I. Осложнения, связанные с токсическим (цитостатическим) действием препаратов.
1. Местнораздражающее (неспецифическое) действие (токсические дерматиты, воспалительные инфильтраты и некрозы подкожной клетчатки), флебиты, асептические циститы и серозиты (плеврит, перитонит и др.).
2. Системные, относительно неспецифические побочные эффекты (миелодепрессия, диспептический синдром, поражение кожи и ее придатков, слизистых оболочек, нарушение репродуктивной функции).
3. Системные, сравнительно специфические побочные действия (нейротоксическое, гепатотоксическое, панкреатотоксическое и кардиотоксическое действие, поражение легких, мочевыделительной системы, коагулопатии, поражения зрительного аппарата, эндокринно-обменные, хромосомные нарушения, тератогенные эффекты, канцерогенное действие в виде возникновения вторых опухолей).
И. Осложнения, связанные с иммунным дисбалансом.
1. Иммунодепрессивное действие (интеркуррентная, бактериальная,грибковая, вирусная и протозойная инфекции,обострение хронической очаговой инфекции, прогрессирование опухолевого процесса).
2. Аллергические реакции (поражения кожи, пульмонит, общие реакции анафилактоидного типа).
3. Аутоиммунные реакции (лейкопения, агранулоцитоз, тромбоцитопения, гемолитическая анемия, васкулиты).
III. Осложнения, обусловленные непереносимостью цитостатика (врожденной сверхчувствительностью, идиосинкразией).
1. Любые непредсказуемые осложнения, но чаще всего связанные с основными цитотоксическими свойствами препарата (миелодепрессия, независимая от дозы, и др.).
2. Парадоксальные и несвойственные фармакологическому действию препаратов реакции (лихорадка и др.). IV. Осложнения, вызванные взаимодействием в организме цитостатика с другими лекарствами (в том числе с прочими цитостатиками).
1. Усиление побочных эффектов, свойственных цитостатику за счет образования новых метаболитов и других механизмов.
2. Появление несвойственных цитостатику побочных эффектов за счет образования новых метаболитов и других механизмов.
3. Усиление цитостатиком токсичности других фармакологических препаратов.
По времени возникновения все побочные эффекты могут . быть разделены на немедленные, возникающие за несколько минут, часов или максимум суток после введения химиопрепарата; ближайшие, развивающиеся во второй половине курса химиотерапии. К первой группе обычно относят тошноту, рвоту, гипотонический синдром, отдельные типы анафилактоидных и идиосинкразических реакций. Вторая группа осложнений обычно охватывает миелодепрессию, диспептический синдром (диарея), поражение слизистых оболочек (мукозиты), неврологические и аутоиммунные нарушения, нефротоксичность, развитие токсических пульмонитов, миокардиопатии, иммунодепрессии и эндокринно-метаболические нарушения.
Согласно рекомендациям Международного противоракового союза, токсические побочные эффекты химиотерапии классифицируют по времени проявления на острые, подострые, хронические и поздние. Поздние, или так называемые отсроченные, побочные эффекты химиотерапии проявляются в пределах от 1,5—2 месяцев до нескольких лет после завершения лекарственного лечения. В клинической практике используются определенные критерии степени тяжести побочных эффектов химиотерапии от 0 (отсутствие) и 1-й степени (незначительные) до 2-й (умеренные), 3-й (тяжелые) и 4-й (угрожающие жизни) степени.
В настоящее время возможности современной химиотерапии значительно расширились за счет внедрения в практику стимуляторов лейкопоэза — гранулоцитарного, гранулоцитарно-макрофагального и макрофагального колониестимулирующих факторов, интерлейкина-3 и интерлейкина-11. Гранулоцитарный колониестимулирующий фактор выпускается под названием «Лейкомакс» (молграмостим), гранулоцитарный — под названиями «Нейпоген» (филграстим) и «Граноцит» (ленограстим). Эти препараты используются для лечения и профилактики «фебрильных нейтропений», а также с целью предупреждения миелосупрессии при интенсификации химиотерапии. Применение новых противорвотных препаратов группы антагонистов рецепторов серотонина (5НТЗ) позволяет полностью купировать тошноту и острую рвоту у 70—80% больных, а в сочетании с дексаметазоном у 70—90% больных, получающих высокоэметогенную химиотерапию (цисплатин в дозе выше 100 мг/м2). Эффект препаратов этой группы (навобан (трописетрон), зофран (ондасетрон), китрил (гранисетрон), латран(<ондасетрон)) связан с блокадой рецепторов 5НТЗ на уровне нейронов периферической и центральной нервной системы.С целью снижения токсичности химиотерапии и одновременного усиления ее эффекта разрабатываются способы хрономодуляции действия цитостатиков. В основе нового метода использованы данные о том, что чувствительность нормальных тканей к воздействию химиопрепаратов ритмично изменяется на протяжении суток. Суточные (циркадные) колебания клеточного деления характерны для гемопоэтической системы, слизистых оболочек всего желудочно-кишечного тракта,эпителия мочевого пузыря, эпидермиса. Установлено, что в период максимальной пролиферативной активности костный мозг, эпителий слизистых оболочек и эпидермис, суточные ритмы которых совпадают, наименее толерантны к цитостатикам. На Международной конференции по хронофармакологии и хронотерапии (США, Вирджиния, сентябрь 1999 г.) обсуждался вопрос о назначении всех известных цитостатиков в определенное время суток. Так, например, все представители группы антрациклинов проявляют выраженную циркадно-временную зависимость в своем токсическом и лечебном воздействии. Для их применения наиболее оптимальным является ранний утренний период. Использование 5-фторурацила в период наибольшей активности катаболических ферментов (ночное время) сопровождается наименьшей токсичностью для костного мозга, слизистой оболочки кишечника и эпителия почечных канальцев, у которых в это время суток снижена пролиферативная активность. Назначение циклофосфана целесообразно в ранний утренний период, так как он угнетает лейкопоэз и является мощным антидепрессантом, а в это время суток имеется максимальный уровень эндогенного кортизола и минимальное количество лимфоцитов в периферической крови перед началом активной пролиферации костного мозга. Основные проблемы современной химиотерапии связаны с первичной и приобретенной химиорезистентностью опухолевых клеток к цитостатикам и недостаточной избирательностью противоопухолевых препаратов. Преодоление химиорезистентности — очень сложная задача. Попытка лечения онкологических больных дозами химиопрепаратов, в несколько раз превышающими стандартные с аутологичной или аллогенной трансплантацией гемопоэтической ткани, представлена методом высокодозной химиотерапии. Современное использование в качестве гемопоэтической поддержки клеток-предшественников гемопоэза из периферической крови и гемопоэтических факторов роста позволяют проводить это лечение при минимальных осложнениях. Высокодозная химиотерапия является терапевтическим подходом для лечения больных с высоким риском раннего рецидива опухолевого процесса, у которых предполагается неэффективность стандартной химиотерапии. Больные с рецидивом злокачественной опухоли после проведенного стандартного лечения; с изначально распространенным опухолевым процессом; с плохими прогностическими признаками, а также больные с первичным поражением костного мозга являются потенциальными кандидатами для высокодозной химиотерапии. Фундаментальные работы в области молекулярной биологии определили совершенно новые направления в создании противоопухолевых средств, которые позволят перейти от лечения нозологической формы опухоли к лечению фенотипических и генетических изменений в опухолевой клетке. В последнее время возможности цитостатической терапии значительно расширились за счет совершенствования методов эндокринного воздействия на опухолевый процесс. Первым указанием на существование гормональной зависимости опухолевого роста было наблюдение ремиссии после овариэктомии у двух пациенток, страдающих раком молочной железы, о котором сообщил Beatson в 1896 г. С тех пор усилия многочисленных исследователей были затрачены на разработку системы эндокринных методов лечения злокачественных опухолей. Существуют опухоли гормонозависимые и гормонопродуцирующие. Для гормонозависимых злокачественных опухолей выраженный лечебный эффект наблюдается только в тех случаях, когда вся опухоль или ее большая часть содержат гормонорецепторы.
В клинической онкологии гормонотерапия как самостоятельный метод используется в лечении рака молочной железы, рака эндометрия и рака предстательной железы. При лечении больных с диагнозом злокачественной опухоли других локализаций гормонотерапия является вспомогательным методом. Например, широкий лечебный эффект глюкокортикоидов с успехом используется для больных с острым и хроническим лимфолейкозом, лимфогранулематозом, злокачественными лимфомами, хотя он занимает скорее промежуточное место между истинно гормональным и цитотоксическим.
В последние годы показана определенная гормональная зависимость колоректального рака, меланомы, рака легкого, в терапии которых гормональные препараты до недавнего времени не применялись. В отношении колоректального рака разрабатываются попытки подавления действия половых стероидов и пептидных гормонов желудочно-кишечного тракта (гастри- на, холецистокинина, бомбезингастринрелизингпептида и др.) и некоторых факторов роста.
При опухолях мозга изучается эффект октапептидных аналогов соматостатина, проникающих через гематоэнцефалический барьер, а при мелкоклеточном раке легкого — близких к ним препаратов ингибитора соматотропинрилизинггормона (гипоталамический гормон, который стимулирует продукцию гипофизарного гормона роста). Имеющиеся сведения о возможной гормонозависимости меланомы и рака гортани еще пока не реализованы в клинической практике.Следует рассматривать три типа гормональных терапевтических воздействий на злокачественные новообразования: аддитивные (дополнительное введение гормонов в дозах, превышающих физиологические), аблативные (подавление образования гормонов) и антагонистические (блокирование действия гормонов на уровне опухолевой клетки). Аблативные воздействия осуществимы с помощью хирургических вмешательств (овариэктомия, тиреоидэктомия, орхиэктомия и др.), наружного облучения эндокринных органов (лучевая кастрация и др.), а также применением фармакологических препаратов, прямо и опосредованно подавляющих синтез гормонов.
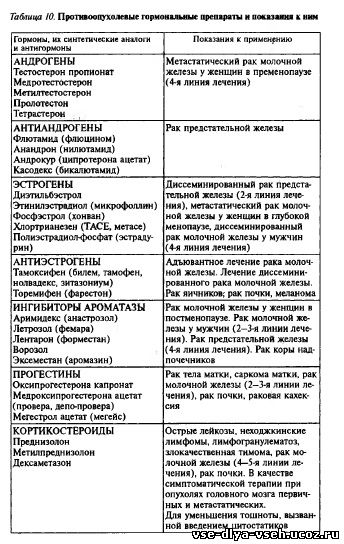
На сегодняшний день основными средствами гормонотерапии злокачественных опухолей считаются стероидные гормоны, а также их синтетические аналоги и антагонисты. Наряду с ними используются белково-пептидные гормоны — препараты гормонов гипоталамуса и гипофиза. Препараты, относящиеся к антиэстрогенам и антиандрогенам, формально не являются гормонами, но их эффект реализуется посредством эндокринных механизмов (табл. 10).
Задача гормонального лечения гормонозависимого опухолевого процесса состоит в подавлении продукции гипофизарных и тканевых гормонов, являющихся стимуляторами роста опухолевых клеток, и блокировании передачи сигналов, способствующих опухолевой прогрессии. Особую группу составляют гормоноцитостатики — препараты, обладающие цитостатическим и гормональным действием, такие, как эстромустин-фосфат (эстрацит) и преднимустин (стерицит). В последние годы активно разрабатывается новое перспективное направление лекарственного лечения онкологических больных — биотерапия злокачественных опухолей, методы которой базируются на достижениях клеточной и молекулярной биологии.
Биотерапия — это комплекс высокотехнологичных методов воздействия на иммунную систему онкологического больного.Иммунная система играет важную роль в возникновении и развитии злокачественных опухолей. Это подтверждается существованием редких спонтанных регрессий опухолей различного типа у человека. Дополнительным подтверждением может служить относительно высокая концентрация иммунокомпетентных клеток в злокачественных опухолях и высокий риск развития злокачественных новообразований у пациентов, подвергавшихся иммуносупрессивной терапии в связи с трансплантацией органов. Поэтому научные исследования в области биотерапии новообразований сфокусированы на различных способах преодоления иммунной резистентности злокачественной клетки. Наибольшее клиническое значение могут получить следующие направления;
• идентификация онкогенов, играющих ключевую роль в процессе канцерогенеза;
• гибридомная технология Получения моноклональных антител;
• исследование механизмов сигнальной трансдукции;
• изучение роли ангиогенеза для опухолевой прогрессии;
• создание методик внесения извне нормальных генов в ге- ном опухолевой клетки;
• расшифровка механизмов распознавания и уничтожения опухолевых клеток системой иммунитета.
На современном этапе биотерапия злокачественных опухолей представлена методами иммунотерапии. Можно выделить три основные цели иммунотерапии злокачественных опухолей:
1} активация лимфоцитов, инфильтрирующих опухоль. Цитотоксические лимфоциты и натуральные киллеры (НК) играют основную роль в противодействии опухоли. В чистом виде'реализация этой цели осуществляется при проведении терапии интерлейкинами;
2) нормализация баланса цитокинов в микроокружении опухоли и в самой иммунной системе. Эта задача реализуется непосредственным вмешательством в процессы пролиферации, ангиогенеза и метастазирования опухоли;
3) преодоление толерантности иммунной системы к опухоли.
Известно, что большинство опухолей не содержит специфических антигенов, которые могли бы стать мишенью для иммунотерапии. Поэтому проблемным является вопрос о представлении опухоли как носителя чужеродной генетической информации собственной иммунной системе организма.
Эта задача реализуется с помощью высокодозной иммунотерапии и химиоиммунотерапии. Различают активную и пассивную иммунотерапии и непрямые методы воздействия на клеточный и гуморальный иммунитет.
Активная иммунотерапия — это методы активации естественного противоопухолевого иммунитета, которые подразделяются на неспецифическую и специфическую иммунотерапии, а также генную терапию. Неспецифическая иммунотерапия предполагает индуцирование активного воспалительного процесса или неспецифическую вакцинацию, местное и системное использование БЦЖ, применение левамизола, интерферона, фактора некроза опухолей, интерлейкинов, колониестимулирующих факторов, высоких доз антиэстрогенов. Потенциальные возможности неспецифической иммунотерапии с использованием интерлейкина-2, интерферона-альфа, лимфокинактивировзнных киллерных клеток, тумор-инфильтрирующих лимфоцитов сопряжены с высокой стоимостью этого лечения, серьезными побочными эффектами и относительно невысоким уровнем объективного эффекта. Активная специфическая иммунотерапия связана с попытками иммунизации больных опухолевыми антигенами, т. е. вакцинацией. Для этого необходимы опухолевоспецифические антигены, которые подразделяются на три категории:
1) специфические опухолевые антигены, экспрессируемые одним видом опухолевых клеток;
2) антигены, экспрессируемые несколькими видами опухолей;
3) тканево-специфические дифференцировочные антигены, характерные для нормальных тканей, из которых возникла опухоль. Эти антигены могут быть продуктами онкогенов (RAS, BCR-ABL, HER2/neu), эмбриональными протеинами (MAGE), вирусными протеинами (EBV, HPV, Hepatitis В), идеотипичными иммуноглобулинами. В настоящее время разрабатываются новые антигенспецифические противоопухолевые вакцины. Пептидные вакцины, рекомбинантные вирусные вакцины, вакцины на основе аминопептидных последовательностей, вакцины на основе дендритных клеток — это лишь некоторые из наиболее перспективных направлений, изучаемых в рамках 1-й и 2-й фазы клинических испытаний. Активно разрабатываются методы генной терапии для моделирования специфического противоопухолевого иммунитета. Примером является создание клеточных вакцин на основе модификации генов, кодирующих выработку цитокинов. Современные программы генной терапии для лечения меланомы и рака почки основаны на стимуляции противоопухолевого иммунитета, опосредованного Т-лимфоцитами. Для этого в изолированные опухолевые клетки вводят гены, кодирующие фактор некроза опухоли, интерлейкины-2-4-6-12 или гены других цитокинов и стимуляторных белков, а затем иммунизируют этими клетками больных подкожно или внутрикожно, в лимфатические узлы или другие ткани. В настоящее время проводят 3-ю фазу клинических исследований по определению эффективности активной специфической иммунотерапии в комбинации с адъювантной химиотерапией у больных раком толстой кишки.
Пассивная иммунотерапия предполагает использование моноклональных антител к дифференцировочным антигенам или онкобелкам, продуктам онкогенов, а также использование клеточных элементов: лимфоцитов, инфильтрирующих опухоль, или лимфокинактивированных киллеров. Возможность внедрения в клиническую практику методов пассивной иммунотерапии на основе моноклональных антител связана с обнаружением поверхностных антигенов у ряда злокачественных опухолей и соответствующим уровнем развития методов биотехнологии. Одной из отличительных особенностей моноклональных антител, по сравнению с химиотерапией, является возможность терапевтического воздействия на опухолевые клетки, находящиеся в фазе покоя (GO). Поэтому очень перспективным для клиники представляется комбинированное применение стандартной химиотерапии и препаратов на основе моноклональных антител.
